Barbeau
de
Fontainebleau
Avon
Bois le Roi
Chartrettes
Fontaine le Port
Hericy
Association de pêche et de Pisciculture
Les Carpes de Fontainebleau - Avon
Qualité de l'eau et pisciculture
Par Jean-Claude Krynicki, webmaster
Introduction
Cette page s'inscrit dans le projet
d'amélioration de la productivité piscicole au Grand Canal de
Fontainebleau. Elle s'adresse à tous les amateurs de pêche qui se
posent des questions sur la qualité de l'eau et sur les éléments qui
contribuent à la multiplication naturelle des poissons.
Le Grand Canal est en fait un écosystème très simplifié car homogène;
son alimentation en eau provient de sources captées dans des forêts
naturelles filtrées par du sable de Fontainebleau;
Les alentours ne comportent pas de rejets industriels ou agricoles et
les jardiniers du château utilisent des produits biodégradables pour
l'entretien des jardins depuis des années.
Il s'agit donc d'un écosystème qui s'apparente à un aquarium à ciel
ouvert et qui contient des poissons depuis plus de 400 ans dont les
variétés les plus exigeantes en qualité de l'eau que sont les truites
.
La structure suit un plan de mesure présenté en Juin 2010 au congrès
de métrologie NCSL International à Providence (USA). L'auteur qui est
aussi le webmaster du site, n'est pas un chimiste ou un biologiste, mais un spécialiste de la mesure électrique. Les
problèmes à résoudre seront donc abordés dans une démarche
expérimentale, avec autant que faire se peut, des outils
de mesure basés sur des transducteurs électroniques qui offrent
l'avantage de fournir des centaines de données, donc statistiquement
représentatives, et pour certains paramètres, des données en continu.Par la suite, nous
avons présenté une autre conférence dans un congrès de métrologie
focalisée sur le problème principal de ce type d'investigation qui est
la sélection des paramètres pertinents.
Plan:
1 Définition d'un écosystème
2 L'étude de cas
3 Le plan de mesure
4 Simulation de la croissance d'une population dans les conditions idéales
5 Présentation systémique
6 Analyse l'homogénéité de l'écosystème et échantillonnage
7 Mesures physiques de l'eau
8 Mesures chimiques de l'eau
9 Mesure de la végétation et des substances organiques
10 Mesure des sédiments et des polluants naturels
11 Analyse bactériologique
12 Influence des composés chimiques sur la chaîne alimentaire
13 Mesure de l'histoire de l'écosystème enregistrés par les poissons14 Soigner l'écosystème
15 Processus de contrôle et de surveillance
16 Conclusions
Sources bibliographiques
1. Définition d'un écosystème
Définition de l’objet à mesurer (mesurande)
Un écosystème est un système formé par l'interaction d'une communauté d'organismes avec leur environnement physique, il se réfère à des éléments combinés physiques et biologiques de l'environnement. Les lacs d'eau douce avec de l'eau se déplaçant lentement, sont appelés écosystème lentique. Les écosystèmes d'eau douce contiennent 41% des espèces de poissons connues dans le monde.
Selon un auteur [1A], un écosystème peut être comparé à une usine de
fabrication de voiture avec une ligne de production principale, la
production de poissons dans notre cas, et plusieurs « chaînes
d'approvisionnement» qui contribuent à l’activité principale (cycle du
calcium, de l’azote, de la photosynthèse, chaîne alimentaire etc. .).
2. L'étude de cas
L'écosystème de notre étude est un canal de 1 km de long, âgé de 4
siècles, faisant partie d’un grand château construit par les rois de
France ; ce canal était utilisé pour le divertissement et l’élevage
des truites.
À cet endroit, une société de pêche a été créée en 1901 ; cette
association a connue une période faste avec jusqu’à près d'un millier
de membres et l'endroit était réputé pour sa grande population de
gardons, carpes, brochets, tanches, perches etc.
Au cours des dernières années, nous avons constaté une diminution du
nombre de poissons au sortir de l’hiver, malgré des rempoissonnements
réguliers.
L'objectif de cette étude est donc de sélectionner les mesures
capables d'analyser l'écosystème, d'expliquer la situation et proposer
des actions correctives. Cet écosystème peut être considéré comme un
cas simplifié car il a bien fonctionné pendant une longue période de
temps et quelque chose a changé qui pourrait expliquer la situation
actuelle, il est bien délimité, semblable à un aquarium géant en plein
air vivant sur lui-même.
L'histoire récente indique que 300 kg de poissons sont ajoutés chaque
année, beaucoup semblent disparaître pendant l'hiver. En 2006, le
canal a été vidé de 6 mois pour l'entretien et des poissons transférés
à un autre bassin du château. 2007 a été une année exceptionnelle avec
un taux de reproduction élevé, facilité par un tapis végétal couvrant
tout le fond. La situation s’est dégradée ensuite; la végétation est
maintenant clairsemée et, par exemple, le rempoissonnement massifs de
carpeaux n’a laissé aucun survivant au sortir de l’hiver. Deux
épisodes de virémie printanière ont fait disparaitre une tonne de
grosses carpes. Par contre, on a constaté que les très grosses truites
passent très bien l’hiver bien qu’elles soient considérées comme les
poissons les plus exigeants pour la qualité de l’eau.
L'opinion des pêcheurs pour expliquer la situation est principalement
liée à des changements récents au sein de leur environnement:
- l’apparition de cormorans après la vidange du canal (qui ont fait
complètement disparaitre un couple de grèbe, un héron et quelques
martins-pêcheurs)
- un campement de gitans, qui a stationné longtemps à une centaine
de mètre de là
- l'entretien du canal qui aurait détruit l'écosystème
(empoisonnement par les résidus de ciment)
- le réchauffement climatique, la pollution, etc
Face à des diagnostics qui n’engagent que leurs auteurs, une
évaluation scientifique est nécessaire et la mesure est la meilleure
façon de confirmer les hypothèse.
3. Le plan de mesure
La stratégie consiste à effectuer une évaluation détaillée de la situation, un inventaire des paramètres et de spécifications, de définir un calendrier, sélectionner l'équipement et effectuer des mesures au cours des 4 saisons.
Lorsque les problèmes sont identifiés des actions correctives seront
appliquées, un tableau de bord synthétique de suivi mis en place et
les écarts seront surveillés pour s'assurer que la situation reste
sous contrôle.
Notre budget de mesure sera de 5 à 10k Euro sur la période, incluant
l'achat d'équipements et la sous-traitance de certaines analyses au
sein de laboratoires compétents.
Champ de mesure
Tout propriétaire d'aquarium d'eau douce sait qu'il peut maintenir des
poissons vivants en filtrant et en renouvelant l'eau, en ajoutant de
l'oxygène, de la lumière, de la nourriture et, de temps en temps, ou
après un incident, en contrôlant moins de 10 paramètres rendant compte
de la qualité de l’eau. La NASA a popularisé une bouteille scellée
avec une crevette pour démontrer qu'un écosystème bien équilibré peut
survivre sans aucun composant externe, sinon la lumière [3A]. .
Dans un écosystème en plein air, la situation est plus compliquée
parce que la nourriture provient du système lui-même, la météorologie
et les plantes sont des sources d'oxygène et d'énergie. Quant à notre
principal support, l'eau, selon la littérature sur la pêche, 23
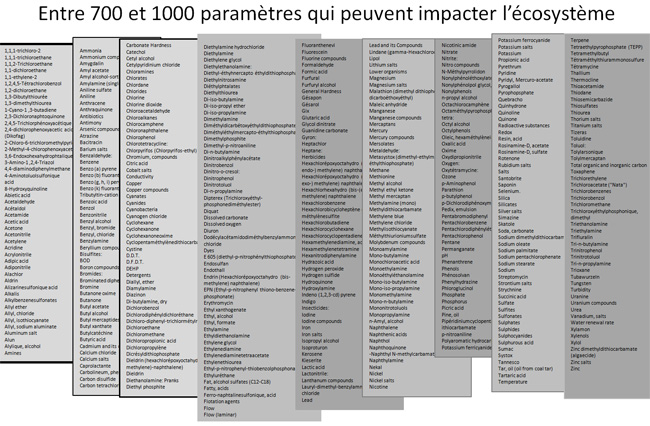
paramètres doivent être surveillés pour une productivité optimale [1A];
environ 350 polluants industriels [3B] et 700 produits pharmaceutiques
[3C] peuvent affecter l'équilibre du cycle de vie, agissant sur les
poissons, le zooplancton, le phytoplancton et les bactéries chargées
du recyclage; La Directive Cadre Européenne a identifié 33 substances
prioritaires et 8 autres polluants à surveiller [3D]. Une organisation
française, l'ANVAR a intégré les substances toxiques naturelles dans
son inventaire [3E]
Face à ces défis, nous devons nous concentrer sur notre objectif principal qui est la production de poissons et d'identifier les substances et leurs quantités létales pour les espèces ou qui ralentissent leur développement; une description détaillée de l'écoulement de l'eau et de la topographie vont nous aider à réduire le nombre de substances suspectes. Par exemple, les nitrates et les pesticides sont plus susceptibles d'être présents si notre écosystème est alimenté en eau de surface provenant des activités agricoles à proximité. Nous devons prendre également en compte le fait que les poissons peuvent se déplacer vers des endroits plus favorables à leur survie. Les variations à court terme sont également importantes, ainsi que la dynamique de l'écosystème au cours des 4 saisons.
L’objet de notre étude se situe dans un parc historique, la réglementation ne permet pas l'installation d'un laboratoire permanent sur le site, ce qui va limiter nos mesures à des échantillons représentatifs ; comme la situation actuelle est issue d'un historique de plusieurs décades, nous avons aussi à recueillir des données provenant de toutes sources disponibles, telles que les stations météorologiques situées à proximité, afin d'identifier des situations climatiques anormales. Les pêcheurs constituent également une bonne source d'information car ils peuvent fournir l'histoire de l'écosystème et ce qu'ils ont observé, au cours des 30 dernières années pour certains d'entre eux.
En Septembre 2012, nous avons présenté au congrès de métrologie IMEKO, dans le cadre du comité technique TC19 (Mesures environnementales) une communication proposant une structure pour mettre en place un plan de mesures afin d’effectuer un diagnostic de bon fonctionnement d’un écosystème aquatique (que mesurer, quand et ou, quelles sont les limites d’acceptation [3F].
Le millier de paramètres et de substances susceptibles d'influencer l'écosystème peuvent faire l'objet du plan de mesure suivant
.
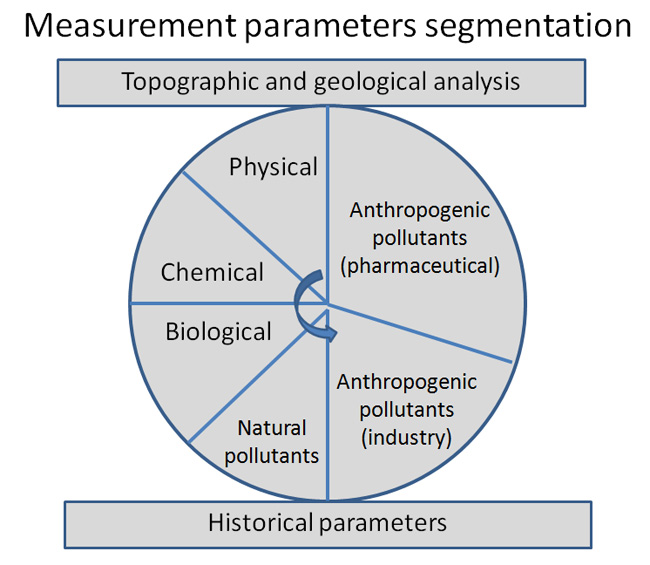
Dans l'analyse topographique il faut examiner l'environnement de l'écosystème. On en déduit les influences de la géologie du bassin versant donc les probables spécifications de l'eau. On doit aussi détecter la présence d'activités agricoles et industrielles sources de pollution potentielle ou d'augmentation de certains composants chimiques comme les nitrates et les phosphates.
Les mesures physiques permettent d'apprécier le degré d'eutrophisation (taux de renouvellement de l'eau), le débit et le débit laminaire donnent des informations sur l'évacuation des matières en suspension ou à leur décantation (augmentation du niveau des sédiments); les flux laminaires contribuent au développement des oeufs et des alevins .
Dans les mesures physiques, la conductivité est un paramètre fondamental pour la surveillance des changements dans la qualité de l'eau; le Redox permet, entre autre de surveiller le développement des bactéries; la température, son rythme de variation et sa répartition en fonction de la profondeur permettent d'identifier les conditions favorables à la reproduction et à la survie des espèces; la turbidité influence la photosynthèse et le développement des plantes aquatiques qui servent de nourriture ou de refuge aux poissons.
Dans les mesures chimiques on controle le pH (niveau d'acidité), le chlore, les paramètres liés à la présence de calcium et de magnésium, les substances liées au cycle des nitrates et des phosphates ainsi que quelques métaux nécessaires à l'équilibres biologique en très faibles quantités et nocifs en grande quantité (zinc, cuivre, fer..).
Les mesures biologiques comprennent l'évaluation des quantités de macro invertébrés (indice biotique) nécessaires à la nourriture des espèces et en particulier des alevins et l'indice macrophyte qui répertorie et quantifie les plantes aquatiques nécessaires au développement des espèces supérieures.
Dans les polluant naturels on prend principalement en considération les gaz provenant des bactéries anaérobies (méthane et sulfure d'hydrogène) ainsi que tous les poisons que produisent les arbres qui sont en bordure des plans d'eau (tanins, .....).
Dans les polluants anthropogéniques industriels, il existe un vaste choix de substances , les plus fréquentes sont le mercure, le plomb, les PCB les produits de l'agriculture ou du jardinage .
Dans les polluants anthropogéniques pharmacieutiques on citera les hormones et les psychotropes. On peut y ajouter les deux principales sources de contamination bactériennes pour l'homme que sont escherichia coli et fecal anterococcus.
Les paramètres historiques comprennent les phénomènes de bio accumulation et la sclérochronologie qui permettent d'identifier tout accident historique dont les traces ont disparu dans les analyses plus récente.
Dans l'analyse de l'écosystème on se concentrera en premier lieu sur la partie gauche du processus, en n'abordant la partie droite, beaucoup plus complexe à quantifier, que si le diagnostic ne fait ressortir aucune explication.
Quelles sont les "spécifications" d'un écosystème "normal" ?
Il existe deux types de spécifications :
Les spécifications "idéales" ou de laboratoire ou tout est contrôlé c'est à dire les spécifications des aquarium d'eau douce.
Les spécifications liées aux bassins versants et à l'adaptation darwinienne des espèces; on doit à Nisbet et Verneaux une étude assez complète des rivières Françaises suivant 16 composantes chimiques (1200 analyses). Cette étude ne prétend pas donner la productivité piscicole d'une eau mais elle permet de repérer une mesure dans une échelle de productivité. Pour chaque paramètre renseigné, nous placerons en vert notre écosystèmes dans cette échelle.
|
pH |
||||
|
pH |
classes |
acidité |
alcalinité |
Localisation |
|
pH<5 |
1 |
forte |
|
sources et ruisseaux supérieurs des régions granitiques,
de tourbières ou forestières - cours d'eau à substrat acide |
|
5<pH<6 |
2 |
moyenne |
|
|
|
6<pH<7 |
3 |
faible |
|
|
|
7<pH<7,5 |
4 |
neutralité approchée |
majorité des eaux piscicoles - régions calcaires |
|
|
7,5<pH<8 |
5 |
|
faible |
|
|
8<pH<9 |
6 |
|
moyenne |
zones inférieures des réseaux - eaux closes ou assimilées -
concentrations végétales en faciès lénitique |
|
pH>9 |
7 |
|
forte |
eaux peu piscicoles ou valeurs passagères - concentrations
végétales en facies lénitique |
![]()
En cours de traduction
4. Simulation de la population des poissons dans des conditions
idéales
Pour mieux comprendre le potentiel de productivité de notre
écosystèmes, nous pouvons effectuer une simple simulation, basée sur
les données d’une seule espèce, le gardon (rutilus-rutilus), en
prenant l'hypothèse de conditions idéales (assez de nourriture, pas de
maladie et pas de prédateur). Un couple de gardons adultes est
introduit en 2010, leur croissance est de 20 g / an, ils produisent 10
000 œufs en mai, et si nous supposons la même quantité de mâle et
femelle, la figure 4A montre que le point de saturation de notre
écosystème (250 kg / ha) est obtenue dans les 4 ans.
Cela conduit à la conclusion que l'effet de l'écosystème est de
limiter l'expansion naturelle de la population. Par exemple la
réduction de la quantité de plantes aquatiques se traduira par un
manque de refuges pour les œufs et les alevins, la diminution du
zooplancton va détruire la quantité d’alevins par famine etc. Par
conséquent notre rendement peut facilement passer de 100% à 1% ou
moins. Cela signifie également que, si les paramètres critiques sont
sous contrôle, le cycle de vie peut reprendre son niveau normal en un
an.
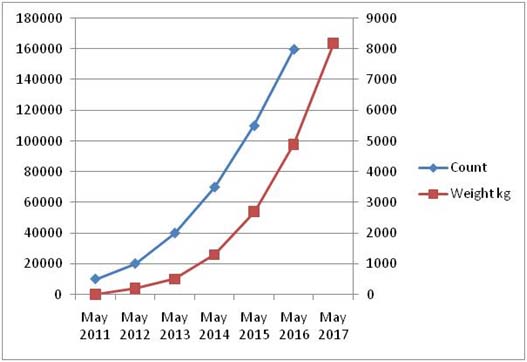
Figure 4A: Evolution idéale d'une population de gardons à partir d'un seul couple
Plusieurs auteurs ont proposé la modélisation
des populations à l’aide d’équations générales en tenant compte du
nombre d’œufs produits par les espèces, du taux de survie des œufs, de
l'abondance de nourriture et du ratio proies / prédateurs [4A]. Une
autre approche consiste à utiliser des coefficients empiriques pour
estimer la richesse piscicole en fonction de l'observation externe ou
à partir d’un échantillonnage [1A].
La réalité est plus complexe: les espèces sont en compétition pour la
nourriture, elles se nourrissent de leurs propres œufs ou de ceux
d’autres espèces ou sont parfois cannibales; les conditions de
température peuvent conduire à sauter une année de production, a
multiplier le nombre de fraies ou à
décaler la séquence de fraie entre proies et prédateurs. Cela
ressemble un chaos déterministe avec des conditions initiales rejouées
au printemps de chaque année. Par conséquent, il est plus réaliste
d’utiliser un modèle de productivité avec une fourchette comprise
entre hypothèse haute et basse, et une marge d'erreur importante.
Mesure de la productivité
La productivité est mesurée en kg / ha (lac) ou kg / km (rivière); les
plus hauts niveaux de productivité se situent entre 250 et 500 kg /
ha.
La méthode standard pour évaluer le nombre de poissons dans un
écosystème est la pêche électrique appliquée à un segment du canal.
Cependant, l’utilisation d’une tension continue de 400 V sous 2
Ampères dans l'eau, est un processus réservé à un nombre limité de
spécialistes formés et n’est pas adaptée à un canal de plus de 2
mètres de profondeur. De plus il ya une pente dans le canal de sorte
que la population de poissons peut migrer en fonction du gradient de
température de l'eau. De ce fait, nous avons choisi une façon la
plus simple pour évaluer la situation en utilisant les données du
volume des captures de la pêche pendant les compétitions annuelles,
qui a lieu au même moment au même endroit et en utilisant des
techniques similaires
|
|
|
|
Figure 4B Exemple de pêche électrique effectuée par les spécialistes
de la Fédération de Seine et Marne dans le Bréau, canal de
faible profondeur qui alimente le Grand Canal |
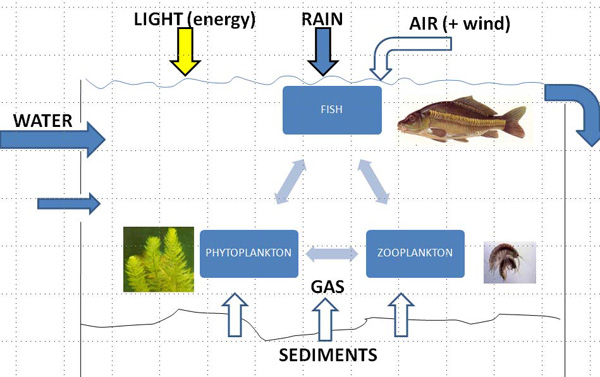
Figure 5A: vue systémique simplifiée de l'écosystème aquatique
Description systémique globale
La figure 5A donne une vue d'ensemble systémique de l'écosystème. La
lumière du soleil fournit de l'énergie pour le développement du
phytoplancton (algues, plantes aquatiques), ce qui sert de nourriture
au zooplancton consommé par les poissons. Les déchets des poissons
nourrissent le phytoplancton, complétant le cycle de la vie. L'eau est
fournie par un flux principal d’alimentation venant du château, de
quelques autres sources et par la pluie. Le vent aide à diluer les gaz
de l’air dans l’eau. Les sédiments sont source de gaz naturels via la
fermentation. L'économie de cet écosystème repose aussi sur
l'équilibre entre les composantes chimiques fournis par les sources
d'eau et les ceux fixés par les organismes morts évacués par le
déversoir.
Cette une vue est simplifiée car il existe de multiples sous systèmes
chimiques et biologiques qui participent à la fabrication de
nutriments.
La principale différence entre une pisciculture et un écosystème
naturel est l'alimentation artificielle fournie dans le premier cas.
Toutefois, la différence n'est pas si importante; Walter [5A] a montré
que la productivité optimale pour les carpes et cyprinidés en général
est obtenu avec 50% d'aliments naturels. Basées sur cette découverte
de nombreuses études ont été menées pour identifier les
caractéristiques du zooplancton et du phytoplancton, les nutriments
dont ils ont besoin pour leur développement et leur contribution à la
chaîne alimentaire (chimique et biologique).
Une question importante est de définir à quel niveau nous devons
placer la limite inférieure de l'écosystème. La couche de sédiments
est une partie intégrante de notre écosystème et pas seulement une
limite physique de l'eau pour les raisons suivantes:
- Les poissons, comme des carpes, fouillent dans les sédiments pour
s’alimenter (vers, coquillages, écrevisses..); plusieurs espèces de
poissons ont une phase d'hibernation, où ils creusent un refuge dans
les sédiments qui peuvent se révéler toxiques pour eux,
- Pendant l'hiver, l'eau de surface est plus froide que celle du fond,
créant ainsi un courant ascendant qui rend l'eau boueuse, avec un
mélange des composants chimiques provenant des sédiments. Le même
mélange se produit quand il ya une tempête et que l’eau est agitée
dans les zones de faible profondeur (moins d’un mètre).
- La surface des sédiments a un rôle important pour le développement
des bactéries, agissant comme une usine de recyclage,
- Les sédiments du canal ne sont supprimés en moyenne que deux fois
par siècle, les métaux lourds comme le plomb utilisé pour la pêche
peuvent s'accumuler et influencer la chaîne alimentaire,
Les spécialistes de la pisciculture recommandent de considérer la
limite physique du fond à 30 cm et d'effectuer l'échantillonnage en
masse sur les 5 premiers cm où la partie la plus importante de ce
qu'ils appellent le «précieux laboratoire" est active [5A]. L'argument
est que les plantes aquatiques, par opposition à leurs équivalents
terrestres, prennent leurs nutriments dans l'eau et non à partir de
leurs racines.
Par conséquent nous pouvons planifier de fréquents échantillonnages
sur les 5 premiers centimètres de profondeur, complétés de quelques
sondages à 30 cm.
6. Analyse l'homogénéité de l'écosystème et échantillonnage
Calcul d'homogénéité à 95% de niveau de confiance
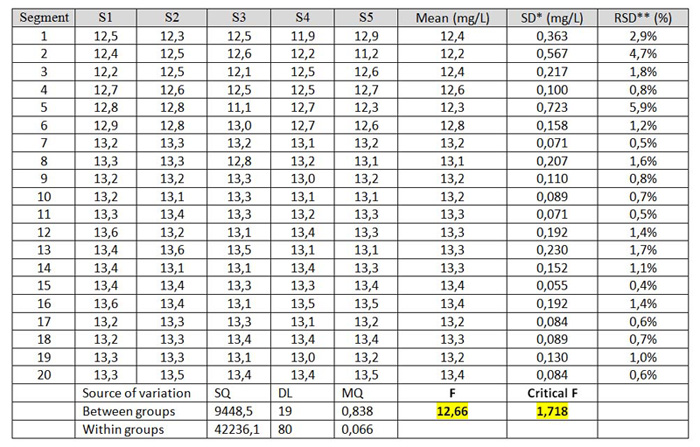
Tableau 6A Calcul d'homogénéité à 90% de niveau de confiance
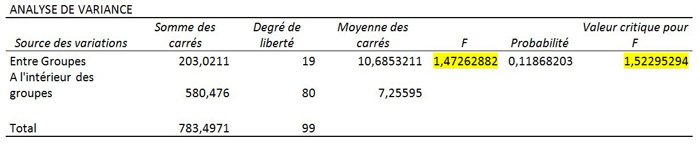
Tableau 6B: test d'homogénéité des 20 segments pour l'oxygène dissous
Le tableau 6A donne un exemple de test d'homogénéité pour l'oxygène
dissous: 20 séries de 5 mesures sont prises dans chaque segment du
canal. L'écart-type et la DSR sont calculées pour la série, une
analyse unifactorielle de la variance (ANOVA à un facteur) est
calculée en utilisant la fonction MS Excel statistiques. Si F <F
critique l'écosystème est considéré comme homogène, sinon, les valeurs
aberrantes sont séparés [6A]. Cet exercice doit être répété au cours
des 4 saisons et pour plusieurs paramètres critiques.
Dans notre exemple F est supérieur à F critique au niveau de confiance
de 95% et inférieur pour un niveau de confiance de 90%; les valeurs
aberrantes peuvent être séparées ; les variations du niveau d'oxygène
dissous sont principalement créés par des sources actives dans les
flancs du canal.. Toutefois un niveau de confiance de 90% est bien
suffisant pour qualifier l’écosystème d’homogène. Nous pourrons par la
suite effectuer la mesure d’oxygène dissous en n’importe quel endroit
et qualifier les résultats de représentatifs.
L'utilisation d'un oxymètre électrique est adapté à l'échantillonnage
en masse, ce n'est pas le cas pour tous les capteurs; les électrodes
de la plupart des capteurs sont protégées contre le contact direct de
l'eau à travers une membrane, un gel ou un mécanisme osmotique. Cette
robustesse a un inconvénient qui est le temps de stabilisation, par
exemple, nous avons expérimenté qu’une sonde Redox demandant 30
minutes pour la stabilisation, par rapport à 15-30 secondes pour
l'oxygène; donc 200 échantillons ne peuvent pas être réalisés dans des
conditions stables. Le temps de stabilisation est une spécification
critique pour ce genre de test.
Nous avons également à mesurer l'homogénéité en fonction de la
profondeur: la température peut varier (thermocline) ainsi que le
niveau d'oxygène s’il y a des courants laminaires.
En France, les mesures de la pollution doivent être effectuées par des
laboratoires d'étalonnage accrédités, y compris l'échantillonnage.
Certains fabricants d'équipement affirment que l'échantillonnage dans
les écosystèmes aquatique contribue à hauteur de 80% à l’exactitude de
mesure [6B]; un spécialiste de la qualité estime que la variance est
constituée de 30% pour l'échantillonnage et 30% pour le transport de
l’échantillon [6C]. Une certification pour l'échantillonnage des
écosystèmes aquatiques a été mise en place en France en 2010 dans le
cadre de la certification du personnel par le COFRAC.
Pratique : Comment sélectionner les récipients qui vont contenir les
échantillons d’eau ?
Nous avons commencé notre étude avec des récipients en plastiques
transparents stérilisés de 1 litre. Par la suite il nous a semblé que
des flacons opaques de 250 centilitres étaient bien suffisants pour
les mesures courantes. Pour les paramètres comme la dureté,
l’alcalinité, les taux de nitrate de chlore etc .. mesurés par
colorimétrie, 5 centilitres par paramètre sont nécessaires. Pour les
mesures électriques (pH, Redox, conductivité …) la contrainte provient
du diamètre de la sonde qui doit être complètement immergée pour fonctionner.
Il est recommandé de plonger les sondes dans des récipients séparés
pour éviter les contaminations ou la diaphonie (crosstalk) entre les
transducteurs qui utilisent des signaux électriques; avec la verrerie appropriée, 15 à 20
centilitres par paramètre s’avèrent suffisants. A quoi il faut ajouter
une centaine de centilitres pour le rinçage des doseurs et récipients.
Nous avons aussi observé que les bouteilles de bière opaques à
fermeture étanche sont très bien adaptées à la mesure des variations
de l’oxygène dissous en fonction du temps (demande biologique ou
chimique en oxygène) ; le clapet évite l’introduction de bulles d’air,
l’opacité du verre prévient de l’influence de la lumière sur les
micro-organismes de l’échantillon, enfin le goulot est adapté au
diamètre de la sonde d’oxymètre. Les brasseurs ont développés ces
types de bouteilles pour éviter l’oxydation de la bière et
l’accélération de la fermentation par la lumière.
7. Mesures physiques de l'écosystème
 Fig 7A Segmentation de l'écosystème et description topographique des arrivées d'eau |
  |
 |
|
Fig 7B: Mesure de la profondeur du canal en utilisant une règle terminée par un disque, complété par un sonar |
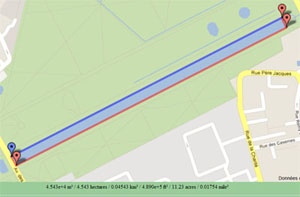
Fig 7C: Estimation du cubage gràce à googlemap et Google Planimeter; pour une structure rectiligne de ce type il suffit de 4 points. |
|
 |
||
|
Exemple d'un étang a géométrie variable dont les berges ont tendance à s'affaisser par suite des galeries creusées par les écrevisses; en utilisant un système d'acquisition Vernier combiné à un logiciel Logger Pro ou autre application GIS on peut tracer les contours de l'étang ; l'ensemble relevé sur le terrain et traitement des données prend moins d'une heure. |
||
|
|
|
|
|
Fig 7D: Débimètre à hélice Vernier |
Fig 7E: Calcul du renouvellement de l'eau à partir d'une mesure de débimétrie appliquée au déversoir |
Fig 7F: Pour les profils irréguliers on segmente l'écoulement et on utilise la fonction d'intégration du débimètre pour calculer la surface |
Topographie
Le canal est le dernier bassin de rétention du château, pour remplir
ce rôle il a un fond en pente et la profondeur varie de 80 cm côté
château à 4 mètres côté exutoire. L'eau provient d'une source située à
2 km dans une colline de la forêt. Cette source d'eau très pure est
captée et conduite par des tuyaux de pierre jusqu’au château, elle
alimente les fontaines et les bassins décoratifs des jardins. De cette
situation, nous pouvons en déduire que l'eau d'origine est directement
issue de la pluie sur la forêt, c'est-à-dire une eau de source très
pure avec des traces de silice. La proximité de jardins peut apporter
plusieurs substances chimiques dégradés tels que les nitrates
provenant des engrais, des fongicides ou des pesticides. On peut aussi
en déduire que les bassins successifs agissent comme étapes de
décantation des particules solides. Par contre, les végétaux
aquatiques à feuilles caduques de ces différents bassins vont être
entrainés en automne par le courant et le Grand Canal de par sa
longueur de plus d’un kilomètre conservera une partie de ces débris
végétaux.
Le canal est entouré par une forêt et un parc clos de grands murs; on
peut considérer que l'environnement reste constant au fil du temps ;
le canal lui-même a été construit avec la technologie du 17ème siècle
en pierres jointives avec une double paroi comblée par de l’argile de
Provins pour éviter les fuites d'eau. Le zinc, le cuivre et le plomb
étaient d'usage courant à cette époque pour diriger les écoulements
d'eau.
La variation de la profondeur a une importance pour notre analyse: les
plantes qui prennent leurs racines dans les sédiments ont besoin de
lumière pour leur photosynthèse, si l'eau est troublée (turbide), les
plantes ne survivent pas dans les zones les plus profondes et notre
écosystème peut être considéré comme non homogène avec des équilibres
chimiques différents, créant des poches de vie et des zones
désertiques.
Le bord du canal est proéminent, ce qui signifie que nous n'avons pas
à prendre en compte les eaux de surface, un contributeur très complexe
pour l’analyse d’un écosystème [7A]. Le canal est aussi le réceptacle
de toutes les eaux du château, alimenté par un tuyau principal et
environ 10 autres tuyaux de drainage. Cette présence d’autres bassins
alimentés par la même eau et avec une situation écologique différente
permet de faire des comparaisons.
Le canal a été conçu avec une orientation est-ouest suivant les vents
dominants fournissant un haut niveau d’oxygène dissous par brassage.
Avec cette bonne qualité de l'eau, les truites ont été introduits dès
le début de l'histoire du canal; la truite est très sensible aux
polluants de l'eau et pour cette raison encore utilisée comme
détecteurs de pollution. Nous devons noter que, malgré la réduction
drastique des populations de poissons, les truites survivent très bien
dans le canal. Cependant les 500 kg de truites introduites lors de 7
lâchés, sont rapidement pêchées pendant la saison, quelques individus
survivent à l'hiver et on ne constate aucune trace de reproduction.
Mesure du volume d'eau
L’intérêt de mesurer le volume d’eau (cubage) conjointement avec le
débit, est de calculer le taux de renouvellement de l’eau. Pour un
aquarium on estime suffisant un taux de renouvellement d'un volume
complet par mois. Les mesures sur d’autres plans d’eau que nous avons
analysé, vont de 5 jours à 1 an ; dans le premier cas il s’agit d’un
étang à truites pour la pêche à la mouche qui fonctionne depuis une
trentaine d'années, dans le second cas la conséquence est une
eutrophisation et la transformation du plan d’eau en marécage. Il est
aussi important d'évaluer le volume si nous voulons ajouter tout
complément chimique ou biologique pour améliorer les équilibres de
l’écosystème.
Le Grand Canal peut être considéré comme un récipient en forme de U,
et avec un volume limité par les dimensions du canal, et le niveau des
sédiments.
Comme expliqué précédemment, nous avons supprimé la contribution des
écoulements de surface à notre modèle, pour prendre en compte la
réflexion de la pluie nous ajouterons la moitié de la surface de la
bordure (50 cm) pour la contribution pluviométrique.
Nous avons divisé le canal en zones de 20 mètres une distance
suffisante pour identifier toute variation locale. La longueur a été
mesurée en utilisant un mètre à ruban de 20 mètres; pour la profondeur
et l'évaluation du profil des sédiments, nous avons utilisé deux
techniques:
- une règle terminée par un disque de 10 cm de diamètre, assez léger pour rester
sur la couche de sédiments et assez lourd pour maintenir la règle
droite,
- un sonar câblés qui a l'avantage d'évaluer avec précision le niveau
des sédiments, même avec une couche supérieure fragiles
Avec un sonar sans fil, il est possible de sonder sur de longues
distances, mais le sonar utilise un cône d'émission de 20 ° ce qui ne
convient pas pour des mesures à proximité du bord du canal; on
constate aussi que la lectures du sonar est perturbée par la présence
de la végétation; les sonars professionnels utilisent des fréquences
variables (de 40 kHz à 400 kHz) pour adapter la mesure à la nature du
fond. Les meilleurs systèmes de mesure sont les sonars à balayage
latéral, d'un prix abordable mais d'un poids importants (quelques kg).
Pour plus d'exactitude et surtout pour les grandes profondeurs, on
utilise maintenant des sonars multifaisceaux couplés
à des GPS corrigés par ondes hertzienne permettant une cartographie
des fonds avec une exactitude de quelques millimètres.
Aspects pratiques:
Un bateau télécommandé est en cours de construction avec un sonar à
sortie analogique pour effectuer des mesures géolocalisées. Après des
essais du système de mesure Vernier sur le profil d'un étang nous nous
sommes rendu compte que la précision d'un relevé GPS sur une surface
plane, permettant de capturer les mêmes satellites, est bien meilleure
que les spécifications GPS publiées (30 cm au lieu de 2 à 10m). Cela
ouvre la voie à des relevés bathimétriques automatisés, permettant de
mesurer l'évolution du niveau de la vase et du volume d'eau d'une
année sur l'autre. Sur un canal on peut s'attendre à rencontrer un
fond homogène; ce n'est pas le cas pour un lac ou les dépots de
sédiments dépendent de la forme des rives.
Notre volume d'eau a été calculé en cumulant les segments
trapézoïdaux. La couche de sédiments a été évaluée avec une règle
rigide. Le plan de masse des archives du château devraient aussi nous
donner les dimensions d'origine.
Pour le débit nous avons utilisé un débitmètre à hélice installé dans
le circuit d’évacuation du déversoir. Un débitmètre à effet hall est
en construction afin de détecter d’éventuels courants d'eau
laminaires. Le taux de renouvellement d'eau et le volume d'écoulement
laminaire sont tous deux importants pour la qualité de l’eau : si le
renouvellement ne se fait qu’en surface, la stagnation dans le bas de
la colonne d'eau réduit le niveau d’oxygène dilué et crée un
environnement favorable au développement de gaz naturels (méthane et
sulfure d’hydrogène) qui sont mortels pour la vie aquatique.
Aspects pratiques:
Le débitmètre à hélice Vernier FLO-BTA couplé à une station Labquest
s’est avéré le plus adapté ; en effet, les tuyaux d’alimentation ont
tous des diamètres différents, il faudrait donc un adaptateur
spécifique pour chaque mesure. Il est beaucoup plus facile, en
supposant l’absence de fuites, de travailler du côté de l’exutoire.
Nous avons aussi rencontré des difficultés à évaluer les faibles
débits ; bien que le débitmètre Vernier soit spécifié de 0 à 4m/s il
faut une vitesse d’écoulement minimale pour entrainer l’hélice et
donner des mesures stables. La vitesse dépendant de la section, nous
avons choisi la première goulotte pour effectuer nos évaluations. Le
débitmètre Vernier possède une fonction d’intégration qui permet de
travailler avec des profils variés comme ceux d’une rivière; le
constructeur conseille d’utiliser une règle pour mesurer la profondeur
en 6 points. Dans notre cas, la section étant rectangulaire il suffit
de multiplier la largeur par la hauteur.
Comme le canal est terminé par une vanne, le volume peut varier en
fonction de l'ajustement, nous avons pris une valeur moyenne.
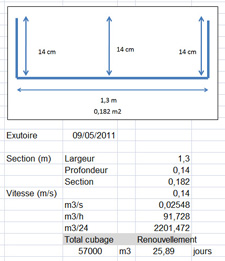
La mesure donne un volume d'eau de 57 000 m3 et 7 000m3 de sédiments;
le taux de renouvellement de l'eau est de 26 jours, la pluie, évaluée
à partir d'une station météorologique à proximité contribue au volume
pour moins de 5%.
En 2006 le Grand Canal a été vidé pour maintenance, son remplissage a
demandé 28 jours ; si l'on prend en compte les 5% d'apport pluvial, on peut donc considérer que notre méthode
d’évaluation est fiable.
Notons que pour les lacs qui ont des formes biscornues, il est
possible d'estimer la surface à partir de google map. et Google
Planimeter
Mesure de la température
La plupart des organismes aquatiques sont à sang-froid, ils sont
incapables de réguler leur température interne. Par conséquent, la
température exerce une influence majeure sur l'activité biologique et
la croissance des organismes aquatiques. Pour notre étude de cas, ce
paramètre a une grande variation, environ 20 ° C au cours des 4
saisons.
La règle Q10 de Van Hoff dit que les activités biologiques et les taux
de croissance doublent si la température augmente de 10 ° C dans la «
zone optimale » de chaque espèce. Cependant, nous ne connaissons pas
cette plage préférée pour toutes les espèces de phytoplancton, de
zooplancton et des poissons qui vivent dans l'écosystème ; donc la
meilleure tactique consiste à reconstruire la température sur une
décennie ou plus, avant les problèmes de productivité, et de détecter
toute déviation anormale, un hiver plus rigoureux, un été plus chaud
qui ont eu lieu récemment et qui peuvent expliquer la situation. La
valeur absolue ainsi que le rythme de changement sont importants, ce
qui signifie que nous avons besoin d’un enregistrement quotidien.
Comme les poissons semblent disparaître pendant l'hiver, nous pouvons
jeter un œil sur la courbe des degrés-jours de la figure 3. Les
degrés-jours sont calculés en utilisant la formule:
HDD = 18 ° C - (Tmax-Tmin) / 2
où Tmax et Tmin représentent la valeur maximale et minimale de la
température quotidienne.
Ce paramètre est utilisé pendant la saison froide pour gérer les stations de chauffage et de
prévoir le budget annuel dont elles ont besoin pour
l'approvisionnement énergétique. Nous avons trouvé une station
représentative à moins de 1 km de notre écosystème et obtenu la courbe
ci-dessous:
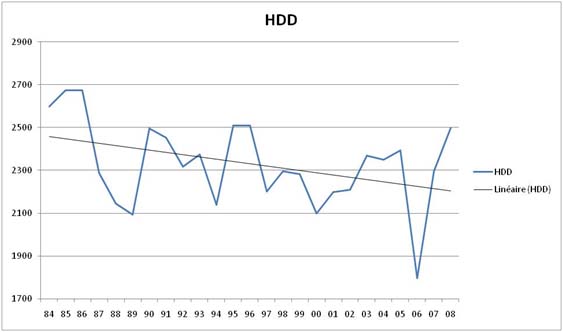
Figure 7G: 25 ans cumulés de degrés-jours de chauffage mesurés à une station de chauffage à proximité
La figure 7G montre le HDD (heating degree day) annuel cumulé sur
plus de 25 ans et nous indique que 2006 a été un hiver
exceptionnellement chaud (HDD plus bas), 2007 et 2008 ont été chauds,
mais à un niveau déjà atteint dans le passé. Plus de granularité peut
être obtenu pour évaluer les variations à court terme.
Les degrés jours dans l'eau peuvent également être utilisés pour
prévoir la période de reproduction des poissons [7B] et la maturation
des œufs [5A].
Pour reconstruire l'histoire de la température de l'eau que nous
pouvons compter sur les stations météorologiques privées, donnant
généralement des mesure maximale-valeur minimale par jour et complétés
par la mesure de l'eau pour calculer une fonction de transfert.
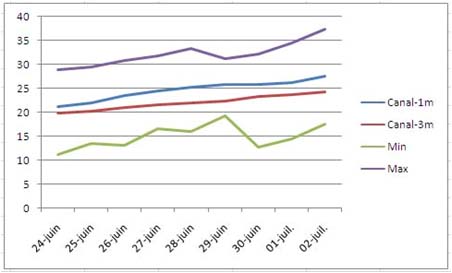
Figure 7H: comparaison entre température maximum (violet) et minimum (vert) d'une station aérienne et deux thermomètres enregistreurs immergés à 1m (bleu) et 3m (rouge).
La figure 7H montre un exemple de ce type de mesure, où une station
météorologique locale, située à 100 m du canal donne la température de
l'air maximale et minimale alors que 2 enregistreurs de données
immergés à 1 m et 3 m de profondeur fournissent l'impact sur l'eau .
En supposant que nous puissions calculer ces données au cours des 20°C
de variations, il est possible de construire une fonction d'ajustement
de courbe (curve fitting) et reconstruire sur les derniers 10 ans
l'histoire de la température de l'eau.
On remarquera la faible différence de température entre 1 et 3m de
profondeur. Quand on examine les courbes de Harvey [7C] pour l'eau de
mer, on se rend compte que les fortes variations (thermoclines) ne
sont observées qu'à partir de 15m.
Aspects pratiques
Nous avons testé plusieurs techniques pour mesurer la température et
conclu qu'un thermomètre à CTN étanche avec câble de 5m est le
meilleur outil pour obtenir des mesures précises a condition de
pouvoir identifier avec précision où se trouve la CTN car la sonde
peut faire 30 cm de long. Pour les
thermomètres immergés, on dispose d’un large choix d'enregistreurs de
données des plus sophistiqués, étanches à 120 m de profondeur avec
interface de communication optique, jusqu’aux enregistreurs USB
économiques pour la température de l’air. Nous avons sélectionné la
solution économique parce que la variation de température dans l'eau
est lente, permettant de placer l'appareil dans un récipient étanche
avec un faible impact sur la réactivité de la sonde ; l'autonomie est
supérieure à un an et le faible coût permet de plonger plusieurs
dispositifs pour faire face aux enregistreurs perdus, volés ou
défectueux.
 |
 |
| Figure 7I: thermomètre enregistreur utilisé pour la mesure de la température de l'eau; après programmation il est placé dans un tube métallique étanche. Les faibles variations journalières dues à l'inertie de la masse d'eau font que les valeurs reflètent bien les variations du milieu. Il est ajusté sur une mesure par heure. Avec une mémoire de 32000 enregistrements, il est capable de stocker un historique de 3 années. C'est la pile qui limite la durée d'utilisation. | Figure 7J: effet de l'écosystème sur le container lors d'un test en étang. Après 2 mois d'immersion, on constate que des moules d'eau douce se sont fixées sur le bouchon du tube en PVC et non sur le tube en cuivre car le cuivre est toxique pour les coquillages. La pression a été telle que de l'eau a pu s'infiltrer dans le dispositif, sans toutefois endommager l'électronique. On peut en conclure que le cuivre est un métal de choix à utiliser quand on veut immerger des sondes pendant une longue durée (container, filtre, crépine, électrodes etc..). |
  |
|
|
Une des conséquences des changements de température au sortir de l'hiver (ici début Mars 2012) : la couche supérieure des sédiments après contraction-dilatation se détache du fond (on dit que le fond "se décolle") car l'eau du fond est plus chaude que l'eau de surface; cela a pour conséquence de réduire la présence de bactéries anaérobies à l'origine des gaz naturels nocifs pour les poissons. Il ne s'agit pas d'une pollution mais au contraire d'une évacuation des polluants naturels. Ces débris doivent-etre retirés sinon ils vont à nouveau ensemencer les sédiments. |
Turbidité et photosynthèse
La turbidité est définie comme une «expression de la propriété optique
qui fait que la lumière peut être dispersée et absorbée plutôt que
transmises en lignes droites à travers l'échantillon". Simplement dit,
la turbidité est la mesure relative de la clarté de l'échantillon.
Elle est différente de la couleur.
La turbidité est un paramètre très important pour l'eau potable parce
que les consommateurs n'acceptent que de l'eau claire. Dans un
écosystème, la faune peut survivre et proliférer dans de l'eau opaque,
qui traduit la présence de nourriture en suspension (algues
monocellulaires), le principal problème de la turbidité concerne
l'effet sur la photosynthèse.
La turbidité est un paramètre complexe à mesurer avec précision,
nécessitant une technique spécifique en fonction de la taille des
particules en suspension. En dessous de 0,45 micron de diamètre nous
avons affaire à des «particules diluées", la lumière sera dispersée
différemment avec les algues monocellulaires, le zooplancton ou les
végétaux aquatiques. Une estimation peut être obtenue en utilisant le
disque de Secchi, un disque de porcelaine de 20 cm avec des segments
en noir et blanc, attaché à un mètre à ruban. Plongé dans l'eau, ce
disque va commencer à devenir invisible à une profondeur donnée, ce
qui fournit une mesure relative de la turbidité.
Cependant il est assez difficile de relier cette mesure à la
productivité de l'écosystème. Si nous voulons comprendre combien
atténuation de la lumière peut expliquer l'absence de végétation à
certains endroits, nous devons mesurer la quantité de lumière
atteignant la surface de sédiments et d'identifier si le niveau de
turbidité est assez élevé pour arrêter le processus de photosynthèse.
Pour contrôler la quantité de lumière reçue par les plantes
terrestres, il existe des capteurs de photosynthèse avec une bande
passante 400 à 800 nm. Malheureusement, aucune sont conçus pour
fonctionner en dessous de 5m d'eau. Notre choix final a été de
modifier un luxmètre pour effectuer nos mesures, un tel dispositif a
une bande passante étroite centrée sur 550 nm. La littérature nous
fournis les résultats de la croissance de plantes aquatiques en
fonction de la valeur en lux [7C]. L'exemple ci-dessous donne le
chiffre pour le développement des diatomées (végétaux marins).
Tableau 7A Nombre de cellules de diatomées, après une culture de 72h sous des niveaux de lumière différentes
|
Si nous voulons mesurer avec précision le cycle de photosynthèse de la
végétation locale, l'Université de Mexico a développé un dispositif de
mesure spécifique [7D].

Figure 7K: plusieurs méthodes pour l'évaluation de la turbidité et de son effet sur la photosynthèse; un disque de Secchi, un photomètre large bande pour les plantes aériennes, un luxmètre
Oxygène dissous
L'oxygène dissous est un paramètre létal pour les poissons, ce qui
peut être illustré par l’évènement suivant : en mai 1992, suite à un
orage à Paris, l'oxygène dissous a été réduite à moins de 4 mg / L et
tué 400 tonnes de poissons en quelques heures, car pour la plupart des
espèces 5 mg / L est un niveau minimum. Cette valeur statique est
réduite au fil du temps par deux paramètres dynamiques:
- Demande chimique en oxygène (DCO) correspondant à la consommation de
l'oxygène par les processus de réduction chimique.
- Demande biologique en oxygène (DBO) correspond à la réduction due à
la consommation des plantes
Du côté positif du bilan il existe un apport d’oxygène par le brassage
de l’air, qui contient 21 mg/L d'oxygène, sous forme de vent ou de
courant.
La température a une influence sur la quantité possible d'oxygène
dissous dans l'eau comme le montre la figure 7L, mais il s’agit là
d’une valeur théorique correspondant à un environnement de
laboratoire. En raison de brassage avec l'air et des courants, cette
valeur peut être "sursaturé", voir l'exemple ci-dessous.
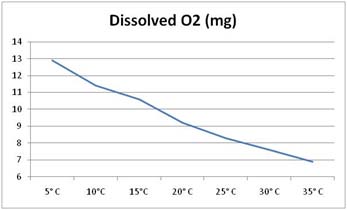
Figure 7L: Oxygène dissous en fonction de la température de l'eau
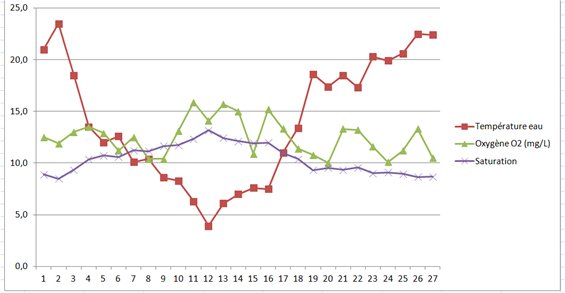
Figure 7M: relevés sur une saison du niveau d'oxygène dissous à 30 cm de profondeur
La figure 7M représente une trentaine de mesures aléatoires
effectuées lors de la saison 2010-2011; la courbe rouge donne la
variation de température de l'eau, elle montre une grande amplitude,
de 4°C en hiver (densité maximale de l'eau) à 23°C en été. La courbe
verte représente la quantité d'oxygène dissous; la valeur reste élevée
(> 10 mg/L) tout au long de l'année, confirmant l'aptitude de cet
environnement à acceuillir des salmonidés. En violet nous avons
représenté la valeur théorique de la saturation (formule simplifiée
O2s = 468,41/(31,64+T°C) ); on constate que la valeur mesurée est
presque toujours située au dessus de la valeur théorique
(sursaturation), et ce à cause du vent et des courants. Nous prenons
nos mesures par temps calme, à 30 cm de la surface; dans ces
conditions nous avons observé qu'une saute de vent fait augmenter de
20% le niveau d'oxygène dissous, un remous de poisson, de 10% . Cela
recoupe la connaissance empirique des pêcheurs à la mouche qui passe
de la nymphe à la mouche sêche dès que le vent se lève car les
poissons se déplacent vers les couches d'eau les plus riches en
oxygène.
L'autre point que nous pouvons remarquer, c'est que l'ensemble des
espèces qui constituent l'écosystème, sont soumises à une variation de
20°C de la température de l'eau; elles s'adaptent gràce à la lenteur
de ces changements.
En raison de l'influence des transports sur l'échantillon, cette
mesure doit être effectuée sur le site. Il existe de nombreux modèles
d’oxymètres avec jusqu'à 5m de câble. Comme les sondes sont sensibles
aux conditions de stockage (niveau d’humidité), un étalonnage de
routine est nécessaire, il se fait en utilisant le niveau d'oxygène
dissous dans l'air (20,9 mg/L). Quand l’ajustement n’est plus possible
il faut remplacer l’électrolyte ou la membrane. Des modèles plus
robustes, basés sur le principe de la phosphorescence sont sans
entretien et peuvent opérer à de grandes profondeurs, mais leur prix
est environ dix fois plus élevé.
Les mesures de la demande chimique en oxygène (DCO) et de la demande
biologique en oxygène (DBO) nécessitent l'utilisation des flacons
hermétiques opaques conservée à 25 ° C pendant 5 jours dans une étuve.

Figure 7N: cet oxymètre de terrain possède une position d'étalonnage (cal) qui permet d'ajuster le zéro et la valeur de pleine échelle en utilisant la valeur de l'oxygène dissous de l'air (20,9 mg/L), pour une pression théorique de 760 mm de mercure (niveau de la mer) . Cet étalonnage doit être appliqué avant toute série de mesures. On ajoute une marque sur le cable pour standardiser la profondeur d'échantillonnage. La sonde doit être maintenue humide pendant le stockage et nettoyée à l'eau douce après chaque usage.
Mesure du pH
Le pH est une mesure du degré d'acidité et l'alcalinité de l'eau, le
ratio entre les ions hydrogène (H+) et les ions hydroxyde (OH-),
exprimée par la formule simplifiée:
pH = -a log10 (H +) .
L'échelle, sans dimension, va de 0 à 14 avec un équilibre entre anions
et cations à 7.
Un pH faible a une influence sur la résistance aux maladies des
poissons, et libère les métaux lourds présents dans les sédiments et
les tuyaux de transport de l'eau ; un pH élevé rend le calcium
insolubles et augmente la quantité d'algues monocellulaires, ce qui
accroit la turbidité et ralenti le processus de photosynthèse.
On estime qu’une valeur de pH entre 6,5 et 8,5 sera tolérée par toutes
les espèces de la faune d'eau douce.
Les variations de pH à court terme doivent aussi être contrôlés, ils
sont influencés par la température, la photosynthèse, et plus
particulièrement par le niveau de carbonate de calcium (en dessous de
20 mg / L de CaCO3, le pH peut passer de 6 à 10 dans la même journée).
Ces variations, ont un impact sur la faune, et favorisent la présence
de l'ammoniac, un composant mortel. Par conséquent, d'autres
paramètres, tels que l'alcalinité (KH) sont utilisés pour mesurer la
façon dont le pH est stabilisé ("effet tampon").
Comme les autres paramètres de l'eau, de multiples techniques sont
disponibles pour mesurer le pH, comme les bandelettes de test, la
colorimétrie, la colorimétrie automatisées et les mesures électriques.
L'utilisation des bandelettes de test et de mesures colorimétriques
est un processus très robuste et peut traiter l'eau polluée sans
détruire la sonde de mesure; les bandes sont immergées, les gouttes
d'eau ou de réactifs sont comptées et les changements de couleur sont
évaluées par rapport à une échelle papier, généralement avec une
graduation d’un pH, ce qui signifie un facteur de 10 pour la
résolution. La colorimétrie automatisée permet d'augmenter cette
résolution [7E].
Les mesures électriques peuvent être très précises car le pH est
également utilisé en médecine, les meilleures possibilités de mesure
(BMC) sont en dessous du seuil de 0,05 pH. Dans ce cas, les capteurs
électriques doivent être étalonnés sur une base régulière (une fois
par mois), en utilisant les solutions de référence à 25 ° C. Pour
faire face à la résolution et les questions de fragilité, nous avons
également acheté plusieurs modèles économiques de pHmètres
électriques, compensé en température, avec une résolution de 0,1pH;
ils sont considérés comme des appareils jetables lorsqu’ils
nécessitent un étalonnage trop fréquent. C'est un problème typique
lorsque l'on mesure les écosystème: en raison de la corruption des
électrodes par l'environnement, un compromis doit être trouvé entre la
précision et l'espérance de vie du dispositif de mesure.
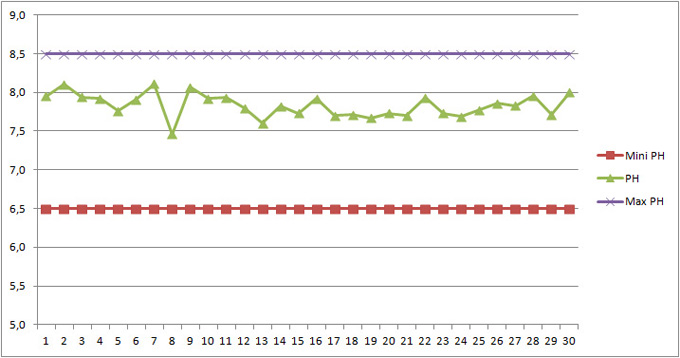
Fig 70: Variation du pH au cours de la saison. La valeur assez élevée favorise la présence d'algues monocellulaires qui augmente la turbidité (eau moins transparente).
|
pH |
||||
|
pH |
classes |
acidité |
alcalinité |
Localisation |
|
pH<5 |
1 |
forte |
|
sources et ruisseaux supérieurs des régions granitiques,
de tourbières ou forestières - cours d'eau à substrat acide |
|
5<pH<6 |
2 |
moyenne |
|
|
|
6<pH<7 |
3 |
faible |
|
|
|
7<pH<7,5 |
4 |
neutralité approchée |
majorité des eaux piscicoles - régions calcaires |
|
|
7,5<pH<8 |
5 |
|
faible |
|
|
8<pH<9 |
6 |
|
moyenne |
zones inférieures des réseaux - eaux closes ou assimilées -
concentrations végétales en faciès lénitique |
|
pH>9 |
7 |
|
forte |
eaux peu piscicoles ou valeurs passagères - concentrations
végétales en facies lénitique |
   |
||
|
Figure 7P: quelques outils de mesure du pH Les mesureurs électriques sont souvent étalonnés à 25°C, c'est la raison pour laquelle les pH mètres sont souvent combinés avec un thermomètre et une compensation automatique de température. Les sondes doivent être stockées humides et nettoyées à l'eau claire après chaque usage. |
La conductivité
Au début du 19ème siècle, pour identifier l’origine des eaux
souterraines, les géologues ont conçu une simple mesure de résistivité
avec un pont d’impédance (pont de Kohlrausch) relié à deux électrodes
carré de 1 cm2 éloignées de 1cm qui sont plongées dans des sources
naturelles ou les puits [7F]. Cette mesure de la résistance d'un centimètre
cube d'eau donne une valeur infinie pour l'eau distillée, en passant
sur les structures géologiques il y a un ajout de sels distillés
(principalement le calcium et le magnésium) et quelques composants
métalliques. La valeur des eaux de source se situe dans la plage 2KOhm
- 5KOhm et elle est stable pour une source spécifique permettant de
retracer l'origine de l'eau. Puis ce concept se transforme en
conductivité (1 / R); finalement on introduit une nouvelle unité de
conductivité capable aussi d'analyser les eaux polluées.
La conductivité permet d'évaluer le niveau d’impuretés présents dans
l’eau (calcium, silice, magnésium, nitrates, etc..) et pour cette
raison elle est considérée comme un bon détecteur des changements
chimiques.
La conductivité est exprimée en Siemens / cm; l'échelle va de 0 (eau
pure) à 200 mSiemens / cm avec un capteur dédié pour chaque gamme de
mesure. Pour notre type d'écosystèmes aquatiques naturel, nous avons
effectué cette mesure en utilisant un capteur électrique couvrant la
gamme 1-10 mSiemens / cm avec une incertitude de 2%.
La conductivité a un impact sur la productivité et le métabolisme
bactérien.
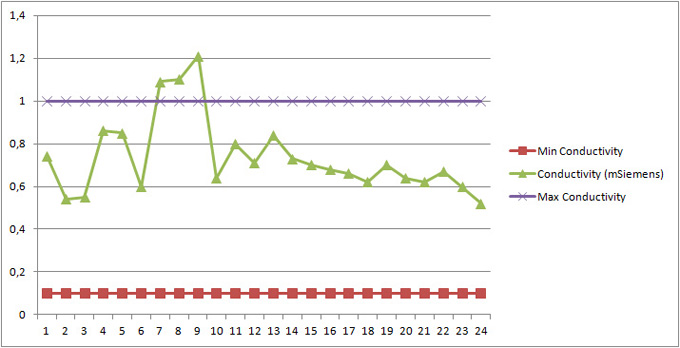
Figure 7Q: Variations de la valeur de la conductivité au
cours d'une saison. Les pointes correspondent à la période du dégel.
|
conductivité
électrique |
classes
|
minéralisation |
exemples de localisation |
|
µmhos/cm/cm2 |
|||
|
µSiemens/cm/cm2 |
|||
|
C < 30 |
1 |
extrêmement faible |
eaux
extrêmement peu minéralisées - lacs de haute montagne - eaux
périglaciaires - quelques sources |
|
C < 00 |
|||
|
30 < C < 50 |
2 |
très faible |
sources et
torrents de haute
montagne -
lacs oligotrophes - cours d'eau à substrat acide |
|
0 < C < 0 |
|||
|
50 < C < 100 |
3 |
faible |
Vosges -
Massif Central -ruisseaux et petites rivières |
|
0 < C < 0 |
|||
|
1 < C < 200 |
4 |
modérée |
nombreuses
rivières côtières bretonnes - Alpes et Pyrénées à moyenne
altitude |
|
0 < C < 0 |
|||
|
200 < C < 300 |
5 |
assez
forte |
régions
calcaires : zones supérieures et moyennes |
|
0 < C < 0 |
|||
|
300 < C < 400 |
6 |
forte |
régions
calcaires (Jura) : zones inférieures, rivières de plaines,
fleuves |
|
0 < C < 0 |
|||
|
400 < C < 500 |
7 |
très forte |
Normandie |
|
|
|||
|
500 < C |
8 |
très forte à excessive |
Var -
quelques rivières lorraines - eaux séléniteuses - eaux
polluées |
|
0 < C |
Aspects pratiques : le transport d’échantillons d’eau ne perturbe
pas la mesure de conductivité et la stabilité est obtenue après
quelques secondes. Cependant, comme cette mesure résume les
changements chimiques et biologiques, nous avons tenté de mettre en
place un enregistreur permanent du même type que celui utilisé pour la
température (faible coût, faible encombrement, faible consommation
pour une autonomie de plusieurs mois, mémoire suffisante pour une
mesure par heure). C’est la raison pour laquelle nous étudions
actuellement un système de mesure fondé sur la première définition de
résistivité car il existe de nombreux enregistreurs du même style que
ceux utilisés pour la température, il suffit de les convertir en pont
de Kohlrausch.
Le Redox
Le Redox (abréviation de réaction d'oxydo-réduction), parfois appelé
ORP (potentiel d'oxydoréduction), est une mesure du degré de pureté de
l'eau, via le potentiel de réaction d'oxydo-réduction. Il est exprimée
en mV.
Selon le type d'eau, la plage de mesure est comprise entre -400mV à +
400 mV; Il y a des débats sur la valeur idéale Redox pour un
écosystème aquatique; la littérature recommande habituellement une
redox entre -200 et +125 mV.
Le Redox, décrit la capacité d'une molécule à perte des électrons.
Pour faire simple, il décrit le potentiel favorables aux réactions
chimiques comme l'oxydation du carbone pour produire du dioxyde de
carbone (CO2). Sans cette capacité à gagner des électrons de nombreux
minéraux ne peuvent pas être absorbés et correctement assimilés
(osmorégulation).
Un haut niveau d'oxydoréduction agit comme un nettoyant
bactériologique: l'augmentation du potentiel redox de 200 mV à 400 mV
permet de réduire de 99% la concentration de bactéries coliformes
(barrière Redox).
Les agents réducteurs, tels que les composés organiques (par exemple
la nourriture, les excréments etc) diminuent le potentiel redox,
indiquant la détérioration de la qualité de l'eau, car ils se
décomposent rapidement en formant des composés toxiques comme
l'ammoniac et les nitrites.
Le Redox est mesuré en utilisant une sonde électrique couvrant toute
la gamme.
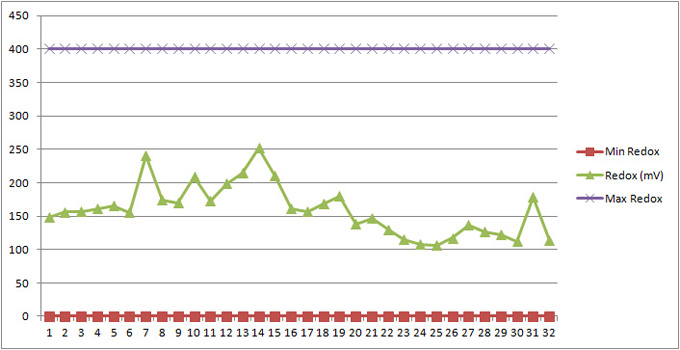
Figure 7R: Variations de la valeur du Redox au cours d'une saison.
Aspects pratiques : Nous avons constaté que le Redox est le
paramètre qui réclame le plus de temps pour la stabilisation de la
mesure. Pour améliorer la situation nous stockons la sonde dans une
solution ayant un Redox proche de la valeur habituellement mesurée.
8. Mesures chimiques de l'eau
Le calcium et le cycle du carbone
Comme un élément fondamental de la construction du corps, le calcium
est nécessaire pour la vie aquatique, agissant sur la formation
osseuse, la coagulation du sang, le système nerveux, l'osmorégulation
et d'autres réactions métaboliques. Il est une source importante
d'énergie pour les bactéries nitrifiantes qui recyclent les déchets,
éliminent l'ammoniac et les nitrites. Plusieurs plantes sont connues
pour fixer le calcium, en compétition avec la faune pour cette
composante importante.
Le dioxyde de carbone est nécessaire pour le développement du
phytoplancton,
La quantité de calcium présente dans l'eau est généralement mesurée
indirectement en utilisant la dureté générale (GH pour global
hardness), paramètre représentant principalement la concentration de
sels de calcium et de magnésium, et un très faible niveau de sels
métalliques (Fe, Cu ..).
Dans un système d’unités international (SI) idéal, la dureté générale
devrait être exprimée en parties par million (ppm) ou en milligramme
par litre de calcium (Ca ++) et magnésium (Mg +) . Mais les chimistes
préfèrent exprimer les composants sous une forme réutilisable par le
cycle de l'écosystème. En pratique, il existe plusieurs unités
dérivées utilisées pour refléter les composantes combinées telles que
le GH allemand (GesamtHärte) basé sur la quantité de mono carbonate
(CaO) en milligramme par litre, les français, les anglais et les
américains utilisent la dureté générale à base de bicarbonate (CaCO3)
et calculée en utilisant le litres, le gallon impérial ou le gallon
américain. Pour cette raison, lors de l'utilisation de révélateur
chimique, il est important d'identifier l'origine du fabricant et, si
nécessaire, pour effectuer une conversion en utilisant la masse
molaire et le volume.
Comme mentionné auparavant, un autre paramètre, la dureté carbonatée
(KH) ou l'alcalinité, représente la concentration en bicarbonate
(CaCO3), qui agit comme un tampon du pH et exprime la capacité de
l'eau à neutraliser les acides.
La littérature allemande mentionne un autre paramètre, le SBV
(«Saürebindungsvermögen»). Une unité de S.B.V. correspond à 50 mg de
CaCO3 par litre d'eau. Les expériences ont donné à la productivité des
poissons en fonction du S.B.V. avec une décroissance exponentielle à 0
en dessous de 2 [5A].
Nisbet et Vernaux [8A] ont analysé 1200 lacs et rivières français en
utilisant un laboratoire mobile et couvrant 16 paramètres, ils ont
créé une typologie de la qualité de l'eau; concernant le calcium ils
ont encore trouvé des espèces de poissons capables de survivre dans
une eau contenant 5 mg / L de CaCO3 (zones granitiques ou
volcaniques), mais la productivité y est très faible. La pratique
courante consiste à considérer la meilleure gamme de dureté
correspondant à des zones alluviales: entre 6 ° et 16 ° dH et un KH
entre 3 ° et 10 ° dH.
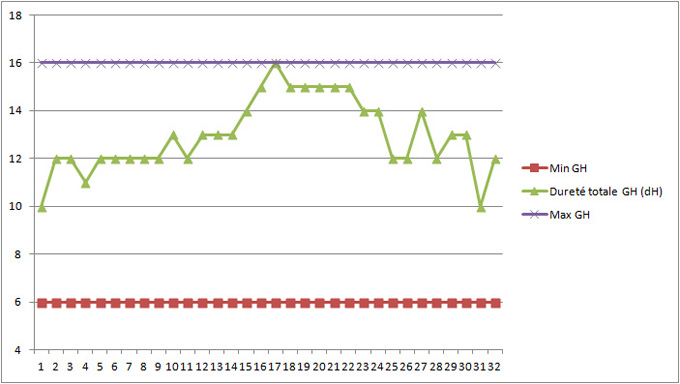
Figure 8A Variation de la dureté totale sur une saison. Valeur et limites exprimés en degrés allemands correspondant aux ensembles de colorimétrie les plus répandus sur le marché, principalement pour la surveillances des aquariums.
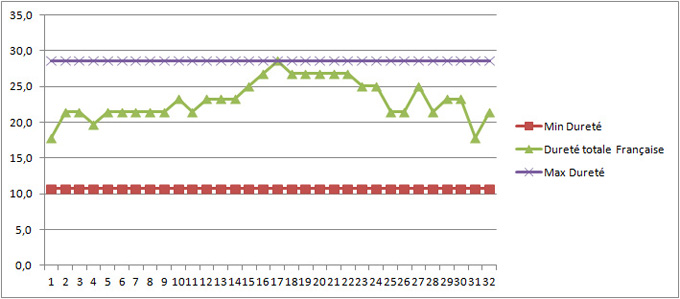
Figure 8B: Dureté totale exprimée en degrés Français; on multiplie par 1,79 pour prendre en compte la différence de masse molaire entre CaO (référence Allemande) et CaCO3 (référence Française)
|
Dureté totale |
|||
|
Ca-Mg mg/L |
classes |
Exemples de localisation |
Indication de |
|
D < 10 |
1 |
roches
éruptives des massifs anciens (Massif Central, Vosges, Massif
Armoricain) et quelques massifs pyrénéens (Ariège, Pyrénées
orientales) - cours d'eau à substrat siliceux (rivières
landaises, Corse) |
eaux très
pauvres peu piscicoles
(oligotrophie) |
|
10 < D < 20 |
2 |
bordures des zones précédentes et suite (les rivières de la
classe 1 (exemples : la Vire et certaines rivières bretonnes,
cours inférieurs des rivières vosgiennes, etc...) |
productivité
faible |
|
20 < D < 40 |
3 |
zone
intermédiaire assez peu représentée en France (ex. : Bassin de
l'Adour et cours d'eau des classes 1 et 2 enrichis par (les
apports latéraux comme l'Allier inférieur) |
productivité médiocre |
|
40 < D < 80 |
4 |
zones
supérieures (le cours d'eau à substrat sédimentaire -régions
calcaires (ex. : cours d'eau alpins et jurassiens, le Rhône et
ses affluents alpins (Durance, Isère et ses affluents), bassin
inférieur de la Garonne (Aveyron, Gers, Lot) |
productivité moyenne |
|
80 < D <
110 |
5 |
presque
toutes les rivières du Bassin Parisien, de Normandie, de la
Basse-Loire, de la bordure occidentale du Jura, des Préalpes
et de la bordure des Pyrénées |
eaux
piscicoles typiques très productives (eutrophie) |
|
110 < D <
150 |
6 |
zones
inférieures des grandes rivières de plaines comme la Saône -
certains cours d'eau des Charentes et du Nord |
eaux dures |
|
150 < D |
7 |
cours d'eau
enrichis par des apports latéraux ou la traversée (le couches
salines; certains affluents de la Meuse et de la Moselle et
cours d'eau (le la côte varoise -- eaux polluées |
eaux très
dures incrustantes (souvent magnésiennes) |
Magnésium
|
Magnésium |
|||
|
[Mg]
en
mg/L |
Classes |
Localisation
(exemples) |
Substrat |
|
[Mg] < 1 |
1 |
massifs
anciens :
zones supérieures (les réseaux hydrographiques (sources et
ruisseaux) |
Roches
éruptives |
|
1 <
[Mg] < 5 |
2 |
massifs anciens : zones inférieures – zones supérieures en
régions calcaires
bassins de l'Adour et de la basse Garonne |
|
|
5 <
[Mg] < 10 |
3 |
la
majorité des cours d'eau français |
roches
sédimentaires calciques |
|
10
<[Mg] < 20 |
4 |
bassin
aquitain (Aveyron-Durance) — Haute-Saône, Ognon |
|
|
20 <
[Mg] < 30 |
5 |
Cours
d'eau de la Côte varoise |
roches
sédimentaires magnésiennes :
dolomies et calcaires dolomiques du Jurassique et du
Trias moyen |
|
30 <
[Mg] < 50 |
6 |
Quelques cours
d'eau lorrains (affluents Meuse-Moselle)- quelques sources |
|
|
[Mg] >
50 |
7 |
idem
classe 6 |
|
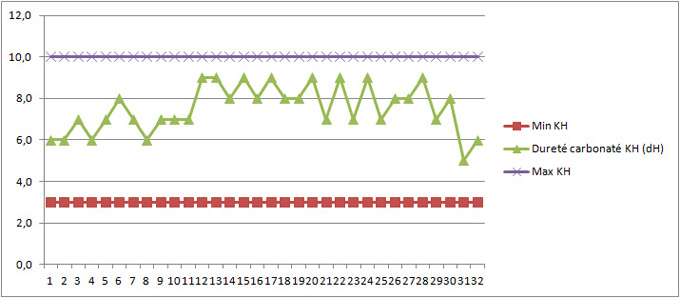
Figure 8C: Variation de l'alkalinité sur une saison. Valeur et limites exprimés en degrés allemands
Alkalinité
|
Alcalinité mg/1 HCO3- |
Teneurs des substances présentes dans l'eau |
types d'eaux |
||
|
|
hydroxides |
carbonates |
bicarbonates |
|
|
P=0 |
0 |
0 |
T |
eaux
normales, piscicoles |
|
P<1/2
T |
0 |
2P |
T-2P |
q.q.
eaux d'étangs ou de canaux à forte activité photosynthétique |
|
P=T/2 |
0 |
2P |
0 |
eaux
polluées |
|
P>T/2 |
2P-T |
2(T-P) |
0 |
|
|
P=T |
T |
0 |
0 |
|
Interprétation.
La concentration en dioxyde de carbone (CO2) peut être déduite du KH / PH en utilisant la formule de Moore [8B].
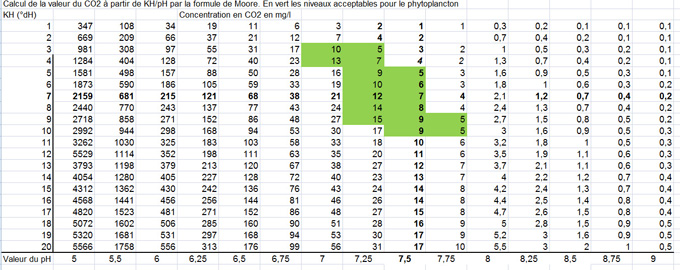
Figure 8D: Calcul de la valeur du dioxyde de carbone (CO2) à partir de la valeur du pH et de l'alkalinité (degrés Allemands)
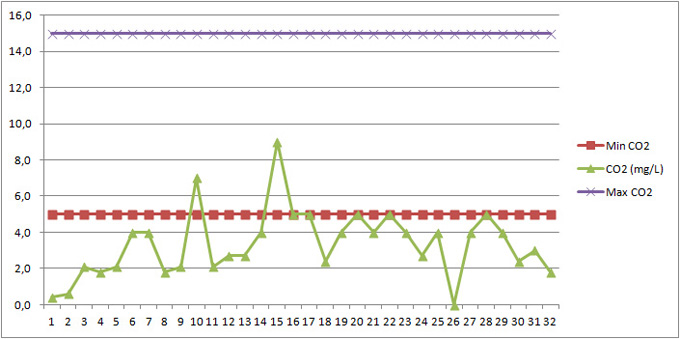
Figure 8E: Variation de la quantité de dioxyde de carbone (CO2) sur une saison. Ces faibles valeurs contribuent à la rareté de la végétation aquatique.
Dureté Général et dureté carbonatée sont facilement mesurées en
utilisant des méthodes colorimétriques. Le calcium et le magnésium
peuvent être évalués individuellement par une méthode électrique à
l'aide et les électrodes sélectives d'ions (Ion Selective Electrode -
ISE).
Le cycle de l'azote
Le cycle de l’azote correspond au recyclage des déchets de
l’écosystème : débris des plantes aquatiques à tiges caduques,
feuilles des arbres, déchets des poissons, cadavres des animaux morts,
nourriture artificielle non consommée comme le pain donné aux carpes
par les touristes etc…
Il est à noter que le canal, en tant que dernier bassin de rétention
des eaux du château, de part sa longueur, se comporte comme un bassin
de décantation, et seuls les objets qui flottent arrivent jusqu’au
déversoir, les autres se déposent au fond.
La période d’évacuation des déchets atteint son pic en automne, si les
eaux deviennent rapidement froides à ce moment, la multiplication des
bactéries se ralenti et un dépôt de matière non recyclée se forme au
fond du plan d’eau.
Sur le plan chimique, il est possible de résumer le recyclage par le
schéma suivant.
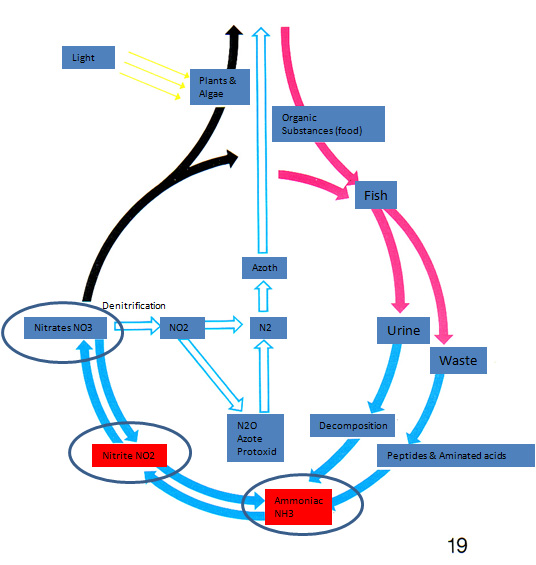
Figure 8F: Schéma du cycle de traitement des déchets dans un écosystème
Les principales composantes du cycle sont, successivement,
l’ammoniac (NH3), les nitrites (NO2), les nitrates (NO3).
Les acteurs de cette activité sont les bactéries nitrifiantes qui,
pour fonctionner ont besoin d’oxygène.
L’ammoniac est une substance létale pour la vie aquatique ; on ne
tolérera qu’une valeur très temporaire inférieure à 0,3 mg/L.
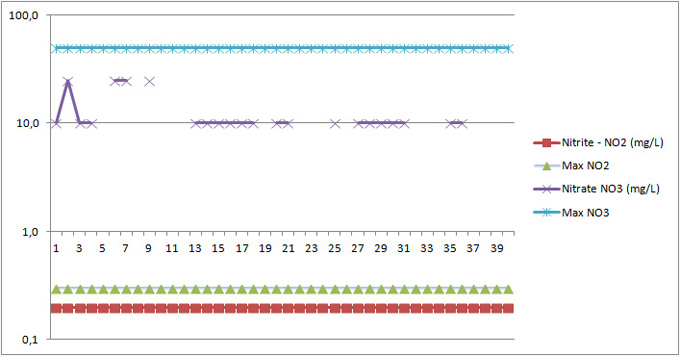
Figure 8G:
Variation de la quantité de nitrates et de
nitrite sur une saison. Pour les nitrites, la méthode colorimétrique
nous limite à une valeur peu précise (<0,3 mg/L).
Autres composants communs (composants secondaires)
Pour les composants secondaires, nous envisagerons plusieurs
substances chimiques qui ont été toujours présentes depuis l'époque
historique. Par exemple on peut qualifier de zinc, de cuivre et de fer
comme des polluants, mais ils sont nécessaires à la vie à un niveau
très faible (traces ou oligo-éléments).
Les substances communes surveillées pour les piscicultures sont
d'ammonium, le cuivre, le cyanure, le fer, le plomb, le magnésium, le
manganèse, le phosphate, le sulfure de zinc, le chlore et le phosphore
Le cuivre, le fer et le zinc ont été d'usage courant dans la
technologie de construction traditionnelle. Le plomb était un usage
courant pour les tuyaux et les 50 ans des activités de pêche ont
probablement entraîné une accumulation de plomb dans les sédiments; en
théorie, un dépôt de carbonate protège de la dilution plomb dans
l'eau, mais cela peut être modifié en fonction des variations de pH ou
la présence de dioxyde de carbone .
9. Mesure de la végétation et des substances organiques
De manière classique on distingue :
- les macrophytes ou plantes aquatiques
- le phytoplancton
Les plantes aquatiques peuvent être a feuilles persistantes ou
caduques (dans notre cas les myriophylle, les charas et les nénuphars)
donc dont l’influence sur l’oxygénation ou la création de CO2 ne
s’exerce que pendant la saison chaude et qui contribue fortement à la
création de déchets à recycler, de vases ou de sédiments.
Le phytoplancton est constitué d’algues monocellulaires en suspension
avec une croissance parfois explosive qui dépend principalement de la
nature de l’eau, de sa température et du pH.
La croissance des algues augmente la turbidité, donnant une couleur
verte à l’eau, ce qui a pour effet de priver les macrophytes de
lumière et de réduire leur croissance. D’un autre côté une eau trouble
protège les poissons des prédateurs externes comme les oiseaux
pêcheurs.
Du point de vue fonctionnel, les plantes aquatiques agissent comme :
- nourriture pour les espèces herbivores (poissons et zooplancton)
- points de fixation pour les œufs (par exemple, les carpes déposent
leurs œufs sur les feuilles flottantes des nénuphars)
- abris contre les prédateurs pour les alevins et les petits poissons
- source d'oxygène en particulier dans le bas
de la colonne d'eau
On peut en déduire qu’un fond continuellement couvert de plantes est
un accélérateur pour la productivité piscicole : meilleure survie des
œufs et des alevins, nourriture en abondance pour toutes les espèces,
oxygénation de l’eau en profondeur en période chaude etc... Ce fut le
cas en 2007 ou, après un a-sec de plusieurs mois, on a constaté une
couverture végétale généralisée, suivie d’une reproduction
exceptionnelle de poissons.
|
|
||
|
Figure 9A:
Plante aquatique la plus fréquente au Grand Canal : la Myriophille |
10 Mesure des sédiments et des polluants naturels
Bactéries de fermentation anaérobie et aérobie
Le méthane est un gaz présent dans les
sédiments naturels, il est mortel, provoquant des embolies gazeuses
des poissons à des niveaux aussi faibles que 2mg / L [10A], le méthane
dissous dans l'eau de nos échantillons ne reflète pas le niveau de
risque associé, car ce gaz est accumulé dans les sédiments et peut
s’échapper brusquement sous des contraintes physiques comme les
changements de température ou les poissons qui fouillent à la
recherche de nourriture; il est aussi présent en diffusion dans les
sédiments quand les poissons sont enfouis pendant l'hiver. Il en va de
même pour le sulfure d’hydrogène (H2S) mais avec des limites encore
plus basses, de l'ordre de 0,002 mg/L [10B]. Les techniques académiques
évaluent les populations de bactéries qui sont identifiées par leur
ADN ce qui permet de calculer la quantité de gaz naturels produit. Ces
méthodes sont hors de portée d’un laboratoire amateur.Les alternatives
professionnelles sont la chromatographie [10C] et les microcapteurs
(électrodes à piquer)[10D].
Par contre le marché offre des capteurs de mesure pour évaluer la
concentration de méthane et de sulfure d’hydrogène dans l'air pour la
sécurité des ouvriers (effet Pelistor) et nous travaillons sur une
méthode pour évaluer cette composante en termes de mg par m2 des
sédiments.

Figure 10A: Dispositif en cours d'essais pour l'extraction des gaz des sédiments; l'outil de mesure en haut à gauche est un équipement Drager servant à la détection des ambiances léthale pour les ouvriers de la chimie, c'est un système léger et autonome que l'on peut donc utiliser sur site et équipé d'une à quatre cellules de détection d'un gaz spécifique avec une portée de 0 à 200 ppm. Le dispositif doit permettre de charger les gaz dans l'ampoule au centre en prenant en compte le fait que le méthane est plus léger que l'eau donc remontera naturellement alons que le sulfure d'hydrogène demande à être pompé. Le système final sera équipé d'une tuyauterie en matériaux spéciaux qui résistent aux gaz agressifs et l'entonnoir remplacé par un cube aux dimensions standardisées avec un agitateur magnétique.
Autres composants
communs (composants secondaires)
Comme composants secondaires, nous envisagerons plusieurs
substances chimiques qui ont été toujours présentes depuis l'époque
historique. Par exemple on peut qualifier de zinc, de cuivre et de fer
comme des polluants, mais ils sont nécessaires à la vie à un niveau
très faible (traces ou oligo-éléments).
Les substances communes surveillées pour les piscicultures sont
d'ammonium, le cuivre, le cyanure, le fer, le plomb, le magnésium, le
manganèse, le phosphate, le sulfure de zinc, le chlore et le phosphore
Le cuivre, le fer et le zinc ont été d'usage courant dans la
technologie de construction traditionnelle. Le plomb était la matière
première pour la fabrication des tuyaux et les 50 ans des activités de pêche ont
probablement entraîné de plomb accumulé dans les sédiments; en
théorie, un dépôt de carbonate de calcium se produit et permet de se protéger de la dilution
du plomb
dans l'eau; mais cela peut être modifié en fonction des variations de
pH ou la présence de dioxyde de carbone .
Polluants
Les données de l'écotoxycologie fournissent les concentrations léthales affectant l'équilibre de l'écosystème c'est à dire qui agissent sur les poissons, le zooplancton, le phytoplancton et les bactéries de recyclage. Les limites sont exprimées en concentration létale moyenne (CL
50) qui est la valeur moyenne causant la mort de 50% de la population sur une période spécifiée. Dans la pratique, les données disponibles ne sont pas très exhaustives: soit nous avons des informations détaillées sur des espèces particulières [9A], soit une collection d'observations expérimentales partielles sur des populations de petite taille [3B]; comme les limites de concentration varient selon les espèces, nous pouvons donc parler d'estimations et nous concentrer sur le maillon faible du cycle de vie. Plus récemment, des chercheurs ont mis en évidence le rôle des "cocktails" de polluants dont la dose léthale est bien inférieure à celle des composants pris séparément.Le nombre de substances candidates à une évaluation reflétent la variété des composants chimiques, utilisés par l'homme, qui peuvent se retrouver dans l'eau. Plus récemment, des recherches ont également montré l'importance des déchets pharmaceutiques, tels que les hormones, les analgésiques et les substances psychotropes, même si elles sont métabolisés ou présents en très petites quantités [9B]. Ces produits peuvent affecter des éléments tels que la reproduction ou la vigilance face aux prédateurs, ils peuvent conduire à l'éradication de l'espèce.
Même si des substances industrielles furent interdites il ya des décennies, comme les biphényles polychlorés (BPC) ou des pesticides, ils doivent encore être pris en considération en raison de leur accumulation dans les sédiments; dans notre étude de cas, 50 années de dépots de couches sédimentaires.
Face à ces défis nous pouvons nous concentrer d'abord sur les
substances couramment utilisées dans notre cas particulier dû à la
conception et la technologie de notre canal, comme le plomb pour la
constitution des tuyaux d'écoulement d'eau, le zinc et le cuivre pour les
toitures. Venant des jardins, bien que depuis de nombreuse années les
produits biodégradables et naturels soient en usage, on pourrait
retrouver des traces historiques de désherbants (atrazine), de substance
phytosanitaires ou d'engrais.
Plus largement, nous pouvons également compter sur la directive européenne
qui fournissent
des priorités et des spécifications pour les polluants les plus
dangereux; gràce à cette directive, il existe maintenant des laboratoires
compétents en mesure d'effectuer leurs évaluations. En 2000, le Parlement
européen a publié la Directive Cadre Eau (DCE) 2000/60/CE de l'UE. Le
but de cette directive est d'établir un cadre pour la protection des
eaux intérieures de surface, des eaux de transition, des eaux côtières et
des eaux
souterraines. Ils ont identifié 33 substances dangereuses prioritaires
et 8 autres polluants à surveiller [3D]. L'objectif est d'atteindre un
«bon état écologique» en 2015 avec des mesures périodiques pour
évaluer la qualité de l'eau.
Pour toutes ces mesures, les techniques utilisées sont la chromatographie et la spectrométrie
nécessitant une préparation sophistiquée des échantillons et mettant
en oeuvre des processus
d'extraction complexes.
![]()
En cours de traduction
Les analyses bactériologiques doivent leur évolution aux normes qui
concernent les eaux de baignade: elles se concentrent sur Escherichia
coli, anterococcus fécal (provenant essentiellement de déchets
humains) et cianobacteria (pour lesquelles l'eau stagnante et le
phosphore ont une importance majeure).
Les mesure sont réalisées par le comptage des germes sur une culture
durant 24h; ce laps de temps n’est plus considéré comme compatible
avec un système d'alerte efficace, c’est la raison pour laquelle,
récemment, des méthodes précise et rapide ont été développées basées
sur la biologie moléculaire (ARN) qui ce concentre sur le comptage des
germes vivants [11A].
L'impact de ces bactéries a été évalué pour les êtres humains, mais
n'est pas très bien connu pour la faune. Comme le canal est utilisé
pour la compétition de natation d'un triathlon, et à l'analyse
bactériologique est une condition préalable pour ce genre d'événements
nous pouvons nous appuyer sur cette évaluation régulière qui
jusqu’alors n’a rien détecté d’anormal.
Une autre source de problème provient des maladies introduites par de
nouveaux poissons et des oiseaux. Pour empêcher la diffusions de
maladies par les produits de l'aquaculture, des contrôles sanitaires
sont effectués ; il existe aussi des directives européennes (91/67CEE
et 93/53CEE) qui permettent la certification des bonnes pratiques. Les
oiseaux sont également sous surveillance depuis la dernière épizootie
(H5N1). Les plans de chasse des cormorans avec prélèvement
systématique des entrailles ont mis en évidence la présence de ténia,
parasites transmissibles aux poissons. On peut aussi remarquer que les
concentrations de dizaines de canards et de bernaches sur les bords du
canal avec les fientes associées ne produisent pas que du phosphore .
Le canal a été l’objet de plusieurs cas de virémie printanière de la
carpe tuant environ 200 kg de représentants de cette espèce; il n’y a
pas de solution pour guérir ce type de maladie sinon que de s'assurer
de la présence de
nourriture et de vitamines pour accroitre la résistance et donc de
mesurer et de contrôler la présence de ces élément (surveillance de
l'indice biotique)
12
Influence des composés chimiques sur la chaîne alimentaire
La dose létale pour les espèces est évaluée en
utilisant le niveau de dilution dans l'eau de chaque substance; la
littérature fournit cette valeur pour plus de 300 composants [3B].
Toutefois, selon la position des espèces dans la chaîne alimentaire,
la concentration des polluants peut considérablement augmenter et être
mortelle pour la faune, même si la dilution dans l'eau peut être
considérée comme négligeable et dans le niveau de bruit de la plupart
des instruments de mesure. L’étude de la pollution par le mercure
montre que le brochet peut concentrer 40 000 fois le niveau de l'eau
(de 0,1 ppb à 4 ppm) [12A]. Par conséquent, ces substances appelées
bioaccumulables, sont mieux quantifiées par le niveau de concentration
dans la chair des poissons plutôt que le niveau de dilution dans
l'eau.
Les programmes de santé publique aident à évaluer la concentration de
ces substances. Il ya une enquête en cours pour mesurer en France PCB
(Polychlorobiphényles) dans le sang des pêcheurs, la chair des
poissons et des sédiments de certaines rivières [12B]. Les techniques
utilisées pour ces mesures (principalement la chromatographie) a
permis de construire un réseau de laboratoires compétents, aptes à
effectuer toute évaluation d'échantillon à un prix abordable.
Figure 2A: Bioaccumulation du mercure dans la
chaine alimentaire : un facteur de 40 000 de l'eau au brochet
13 Mesure de l'histoire de l'écosystème enregistrés par les poissons

Figure 13A: relation entre la ligne de
croissance des écailles des poissons et le développement physique
L'impact global de l'écosystème, plutôt que d'être déduit des
influences extérieures, peut être évalué à partir du poisson lui-même
en utilisant la sclérochronologie (mesure des stries de croissance). Cela peut
fournir la vitesse de croissance (spécifique à l'espèce), l'âge (à
comparer avec le poids et la longueur) et l'histoire de
l'environnement (l'abondance de nourriture annuelle) avec une durée pouvant
aller jusqu'à 20 ans pour les carpes [13A]. Pour les poissons sans
écailles, de petits os dans la tête (otholithes) peut aussi donner
accès à
ces lignes de croissance
Ces mesures délicates de dimensions bénéficient de techniques très
précises en provenance de la dendrochronologie (l'histoire du climat
basée sur les lignes de croissance des arbres) et la paléontologie
(mesure de l'âge des fossiles de dents grâce à la scarification
dentine). L'équipement nécessaire à cette mesure peut se composer d'un microscope avec un
pilotage des déplacements de l'échantillon à l'aide de vis
micrométriques.
14 Soigner l'écosystème
L'eau de notre canal, de bonne qualité, est renouvelée chaque mois, alors qu’une
couche de sédiments accumulés pendant 50 ans peut influencer
l'équilibre chimique et biologique de cet écosystème. Donc, la
première idée qui vient à l’esprit est de « repartir à zéro» en
supprimant tous les sédiments, puis d’ajouter un amendements en chaux
vive pendant quelques mois pour nettoyer le sol de ses bactéries [5A].
Cependant, il ya deux limitations à cette solution:
- la première est que le canal, suivant la technique du 17ème siècle,
est rendu étanche à l'aide d'une double paroi de pierres séparée par
une couche d'argile de Provins; l’élimination de l'eau pendant une
longue période risque d’assécher la couche d’argile et de détruire de
façon permanente son étanchéité; cela suppose aussi l’utilisation
d’une barque équipée d’une pompe aspirante, d’un bassin de décantation
mobile et d’un système de compactage.
- la deuxième limitation est économique: en raison de normes de
pollution européennes, les sédiments aquatiques doivent être traités
dans un site compétent pour filtrer les éventuels métaux lourds. Une opération
similaire effectuée pour un autre canal de château a duré 6 mois pour
un coût de 100 millions d’euros.
L’apport ponctuel de composants chimiques peuvent aider à récupérer
l'équilibre de l'eau; les substance la plus couramment utilisées sont
le calcium, pour équilibrer le pH et les cocktails d’oligo-éléments
(zinc, cuivre, sélénium etc ..)
Réduire la couche de sédiment et de vase permet d’augmenter le volume
d’eau donc de jouer sur la masse thermique de l’écosystème, ce qui a
pour effet « d’écrêter » les pointes de températures ; ainsi en
gagnant un mètre sur la profondeur on pourrait espérer obtenir 20°C de
température maximale dans les chaudes journées d’été, contre 23°C
actuellement.
Pour nettoyer les sédiments des gaz naturels comme le méthane et le
sulfure d'hydrogène, il existe trois techniques :
- Injecter de l'air et ses 21% d’oxygène dans les sédiments pour tuer
les bactéries anaérobies qui sont à l’origine de la production de ces
gaz naturels.
- Mélanger à la vase des substances microporeuses (coccolite, coraux)
qui font entrer de l’oxygène dans les couches enfouies
- Utiliser des bactéries concurrentielles aux bactéries anaérobies
afin de les éradiquer
Il est à noter que le développement des bactéries de recyclage est
fortement dépendant de la température [14A]; dans les séquences
climatiques de ces dernières années, des automnes très doux ont
retardé la chute des feuilles ; quand celle-ci s’est produite, elle a
été suivie des premières gelées, ce qui a conduit au blocage du
recyclage et à la formation d’une couche de feuilles au fond du plan
d’eau favorisant le développement des bactéries anaérobies.
Pour augmenter le niveau de nourriture naturelle pour les alevins, il
existe des amendements biologiques avec des résultats allant jusqu'à
20gr de daphnies par mètre cube d'eau [5A].
La végétation joue également un rôle important dans la santé des
écosystèmes; des recherches récentes ont montré qu'à condition de
laisser stagner l'eau 3 jours dans une zone humide, certaines plantes sont capables
d'absorber jusqu'à 95% des polluants, y compris les dérivés des
produits pharmacieutiques [11A].
15
Processus de contrôle et de surveillance
Les
paramètres de l'écosystème peuvent être contrôlés séparément à l’aide
d’indicateurs de suivis; afin de réduire le nombre des cartes de
contrôle dans le tableau de bord, nous pouvons sélectionner des
paramètres comme la conductivité ou le redox qui sont de bons
détecteurs de changements.
Après des années de mesures de la pollution, tels que les taux d'ozone
dans l'air, qui ont conduit à des décisions critiques, la question a
été soulevée de trouver une méthode capable de discriminer entre des
séries de valeurs aberrantes ponctuelles et de réelles déviations par
rapport aux limites tolérées. Le Collège Français de Métrologie a
étudié la question en collaboration avec les statisticiens du
Laboratoire National français (LNE). Ils recommandent d'utiliser la
carte de contrôle EWMA (Exponential Weighted Moving Average) pour les
processus de surveillance [15A].
Lorsque plusieurs paramètres doivent être comparés au fil du temps, le
diagramme Schoeller est capable de groupe de 8 composantes principales
de l'eau sur un seul graphique [15B].
Plusieurs auteurs ont essayé de jouer sur les valeurs d’échelle de
paramètres significatifs de façon à montrer, d’un seul coup d'œil, si
certains éléments s’écartent de la situation d’équilibre. La figure
15A est un exemple : le regroupement en un seul graphe de l'oxygène
dissous, de la DBO en quatre heures, de la température, du pH, de la
conductivité et du calcium. Lorsque l'écosystème est équilibré, les
valeurs suivent une ligne droite, une forme de zigzag repérer une
situation anormale [1A].
 |
| Figure 15A: un exemple de
représentation globale d'un équilibre de l'eau |
![]()
En cours de traduction
![]()
En cours de traduction
References
[1A] Jacques Arrignon – Aménagement piscicole des eaux intérieures
(Inland water fish management) S.E.D.E.T.E.C. Edition 1970
[3A] Recipe for an ecosphere – NASA publication
[3B] F. Meinck, H. Stooff, H. Kohlschutter Industrie – Abwasser; Gustav Fisher Verlag – 1968. French version: Les eaux résiduaires industrielles. Masson 1977.
[3C] Yasmin Guler, Alex T. Ford. Anti-depressants make amphipods see the light. Aquatic Toxicology, 2010
[3D] Directive 2000/60/EC of the European Parliament and of the Council establishing a framework for Community action in the field of water policy - 23 October 2000
[3E] Evaluation des risqué lies à la présence de cyanobactéries et leurs toxines dans les eaux – Evaluation of risks associated with the presence of cyan bacteria and their toxin in water. AFSSA – 2006
[3F] MEASUREMENT PLAN FOR THE DIAGNOSE OF AQUATIC ECOSYSTEMS Jean-Claude Krynicki, Alban Benoist, Damien Bouchon - XX IMEKO World Congress Metrology for Green Growth September 9-14, 2012, Busan, Republic of Korea
[4A] Simulation of fish population responses to exploitation- AL Jensen - 1991[5A] Wilhem Schaperclaus - Lehrbuch der Teichwirtschaft – Paul Parey ed. - 1961. French translation: Traité de pisciculture en étang. Vigot ed. 1962.
6A] First round of the proficiency test scheme on Brazilian Cachaça Akie K Avila, Renata M H Borges, Thiago de O Araujo, Maria Cristina B. Quaresma, Fabio S. Bazilio, Ligia C.C. Oliveira – XVIII IMEKO world congress 2006
[6B] Mieux maîtriser l’analyse et le prélèvement ; Better control of analysis and sampling - Hydroplus magazine May 2010
[6C] Philippe Quevauviller Metrologie en chimie de l’environnement – Environmental chemistry metrology Edition Lavoisier 2006
[7A] Multivariate Analyses (Canonical Correlation and Partial Least
Square (PLS)) to Model and Assess the Association of Landscape Metrics
to Surface Water Chemical and Biological Properties Using Savannah
River Basin Data - Maliha S. Nash and Deborah J. Chaloud U.S.
Environmental Protection Agency; Las Vegas, Nevada date ?[7B] PLS used for reproduction with HDD (en cours de recherche
des références exactes de ce
document ayant depuis disparu d'internet)
[7C] Recent Advances in the Chemistry and Biology of Sea Water
Cambridge University Press, 1945. French version: Chimie et biologie
de l’eau de mer H. W. Harvey PUF 1949.
[7E] Field Photosynthesis Measurement Systems; Rafael
Figueroa-Viramontes Concepción Lujan-Alvarez
[7E] Water analyses ; Highly dynamic colorimetry; L’eau, l’industrie, les nuisance magazine issue 332 May 2010
[7F] Hydrologie Agricole; Frédéric Dienert; Librairie JB Baillière et Fils - 1907
[8A] Nisbet et Verneaux Annales de limnologie, t. 6, fasc. 2, 1970, p. 161-190
[8B] Moore E.W. Graphic determination of carbon dioxide and 3 forms of Alkalinity Journal A.W.W.A. – 1939
[9A] L’analyse chimique et physico chimique de l’eau. Chemical and physicochemical analysis of water. J Rodier Dunod Paris 1960
[9B] Les substances émergentes dans les eaux : Problématique générale, présentation d’une démarche de recherche de substances médicamenteuses dans les eaux de surface et les eaux souterraines dans une région française (Emerging substances in the waters: General questions, presentation of a research of drug substances in surface water and groundwater in a French region). Laurence AMALRIC, Sébastien BRISTEAU, Thierry DAGNAC, Roger JEANNOT- CAFMET 2008
[10A] Natural gas in the marine environment Stanislav Patin
[10B] Effect of hydrogen sulfide on fish and invertebrates - EPA 600/3-76-062A-July 1976- Part 1 Acute and Chronic Toxicity Studies
[10C] Hydrocarbon Processing; Agilent technologies Application note 5989-9249 EN
[10D] A H2S microsensor for profiling biofilms and sediments : application in an acid lake sediment. Michael Kuhl - Aquatic microbial ecology Vol 15 201-209 - 1998
[11A] Les développements récents en aval de la ville: gestion des milieux et des écosystèmes ; la zone « libellule » ; Recent Developments in downstream cities : management of medium and ecosystems ; the “dragonfly” zone. 12th Cannes Water Symposium – 2010.
[12A] Écotoxicologie (ecotoxycology) François Ramade Editeur : Masson. 1977
[12B] PCB program
[13A] Manual of Fish Sclerochronology (Ifremer-Ird)
[14A] Mémento technique de l'eau (Degrémont-1972)
[15A] Surveillance des Processus de Mesure (measurement surveillance process) – Collège Français de Métrologie- Edition 2009
[15B] H. Schoeller, Hydrogeology. Institut Français du Pétrole, 1955, Vol 2
![]()
En cours de traduction
[xx] Qualité des eaux de baignade, adaptation d'une méthode enzymatique rapide de détection pour Enterococci- Marion Peirache- Cannes Water Symposium 2011
[xx] Water quality monitoring. A practical guide to the design
and implementation of fresh water quality studies and monitoring
programmes. Taylor and Francis 1996.
[20] Biotic Index AFNOR NFT 90-350 – 19xx
[3A] Écotoxicologie (ecotoxycology) François Ramade Editeur : Masson.
1977.
[24] PCB program
[29] Water Quality with Vernier - Robyn L. Johnson, Dan Holmquist, Kelly Redding; ISBN: 978-1-929075-45-4
[ ] Des arbres qui peuvent contrarier l'essor piscicole - Pierre Pellerin - La pêche et les poissons Mars 1969
![]()
![]()
Mise à jour